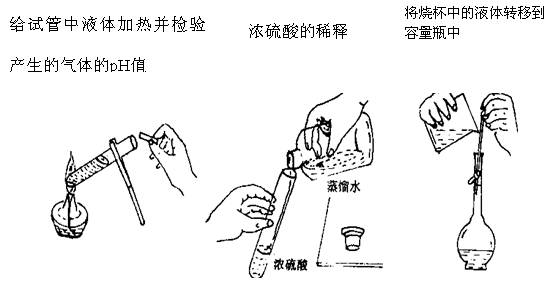
-
许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A. 氯、溴、碘 B. 钠、镁、铝 C. 烧碱、氢气 D. 食盐、淡水
难度: 简单查看答案及解析
-
各物质按强电解质、弱电解质、非电解质、既不是电解质又不是非电解质的顺序排列的一组是
A.NaOH、HClO、SO2、H2O B.NaCl、SO3、NH3、H2O
C.BaSO4、NH3•H2O、CO2、Fe D.H2SO4、H2S、H2O、C2H5OH
难度: 简单查看答案及解析
-
等物质的量的氢气和氦气在同温同压下具有相同的
A.原子数 B.质量数 C.体积 D.质量
难度: 简单查看答案及解析
-
根据下列微粒结构示意图的共同特征,可把
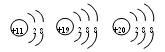 三种微粒归为一类。下面的微粒可以归为此类的是
三种微粒归为一类。下面的微粒可以归为此类的是
难度: 简单查看答案及解析
-
下列物质中含有Cl-的是
A.液氯 B.氯化钠 C.次氯酸钠 D.氯酸钾
难度: 简单查看答案及解析
-
对于 AZX和A+1ZX+两种粒子,下列叙述正确的是
A.质子数一定相同,质量数和中子数一定不同
B.化学性质几乎相同
C.一定都由质子.中子.电子构成
D.核电荷数,核外电子数一定相同
难度: 简单查看答案及解析
-
汤姆孙提出原子的葡萄干面包模型的主要依据是
①原子的构成中有电子 ②原子的构成中有质子 ③原子的构成中有中子 ④整个原子是电中性的
A.①② B. ①④ C.①③ D. ②④
难度: 简单查看答案及解析
-
不能用Cl2 跟金属单质直接化合制取的物质是
A. AlCl3 B. FeCl3 C. CuCl2 D. FeCl2
难度: 简单查看答案及解析
-
同温同压下,下列关于氢气和氯气的叙述中,正确的是: ① 等体积的氢气和氯气所含的分子数相同;② 氢分子间的平均距离和氯分子间的平均距离几乎是相等的;③ 氢分子与氯分子的大小相同;④ 氢分子和氯分子本身的大小对于气体体积影响可以忽略不计。
A.①②③ B.①②④ C.①②③④ D.①④
难度: 简单查看答案及解析
-
下列微粒电子式书写错误的是
难度: 简单查看答案及解析
-
用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏高的是
A.在烧杯中溶解时,有少量液体溅出
B.为加速固体溶解,可稍加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容
C.容量瓶使用前未干燥
D.定容时仰视容量瓶刻度线
难度: 简单查看答案及解析
-
已知两瓶气体,分别是HCl和Cl2。可以区别它们的方法或试剂是
① 观察颜色 ②打开瓶盖看有无白雾 ③湿润的淀粉试纸
④湿润的红色石蕊试纸 ⑤湿润的蓝色石蕊试纸 ⑥硝酸银溶液
A、①②③④ B、①②⑤⑥ C、①②④⑤ D、①②④⑥
难度: 简单查看答案及解析
-
在实验室粗盐的提纯实验中,玻璃棒的使用不具有的作用是
A.在溶解过程中搅拌 B. 在蒸发过程中搅拌
C.在过滤时引流 D. 使固体析出
难度: 简单查看答案及解析
-
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A.
mol/L B.
mol/L C.
mol/L D.
mol/L
难度: 简单查看答案及解析
-
如图.A处通入Cl2.当关闭B阀时,C处湿润的红布条没有明显变化,当打开B阀时,C处的湿润红布条逐渐褪色.则D瓶中装的溶液是
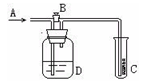
A、浓H2SO4 B、NaOH溶液
C、水 D、饱和食盐水
难度: 简单查看答案及解析
-
一定量碳(由12C、13C组成)和足量氧气(由16O组成)反应所得CO2气体,对氢气的相对密度为22.495,则该碳中12C和13C的原子个数比为
A.1∶100 B.1∶99 C.100∶1 D. 99∶1
难度: 简单查看答案及解析
-
某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35 g H2O,析出晶体5 g;乙烧杯中的溶液蒸发掉45 g H2O,析出晶体10 g。则原溶液的质量分数为
A.10% B.15% C.20% D.25%
难度: 简单查看答案及解析
-
氯气通入石灰乳制得漂白粉.其主要成份是Ca(OH)2·3CaCl(ClO)·nH2O,贮存过久的漂白粉与浓盐酸制得的Cl2中,可能含有的杂质气体中量最多的是
A、O2 B、CO2 C、HCl D、 H2
难度: 简单查看答案及解析
-
在常温下将盛满Cl2的一支试管倒立在水槽中,当日光照射一段时间至不再反应为止,试管中最后残留的气体约占整个试管体积的
A、1/4 B、1/3 C、1/2 D、2/3
难度: 简单查看答案及解析
-
制备HCl气体,下列方法可行的是
①NaHSO4+MnCl2(固)共热 ②浓H2SO4+浓HCl共热
③浓H2SO4+KCl(固)共热 ④浓H2SO4+NaCl(固)+MnO2共热
A.①③ B.①②③ C.①③④ D.全部
难度: 简单查看答案及解析
-
以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列关于氯化氢和盐酸的叙述中,正确的是
A.它们都用HCl表示,两者没有区别
B.氯化氢和盐酸在潮湿的空气中都形成酸雾
C.氯化氢和盐酸都能导电
D.氯化氢是无色气体,盐酸是无色溶液,它们都有刺激性气味
难度: 简单查看答案及解析
-
设NA为阿佛加德罗常数,下列叙述中正确的是
A.46 g NO2和N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2 中含中子数为2NA
C.1 L 1 mol/L醋酸溶液中离子总数为2NA
D.0.1molOH-含NA个电子
难度: 简单查看答案及解析
-
下列两种气体的分子数一定相等的是
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO和C2H4
C.等温等体积的O2和N2 D.等压等体积的N2和CO2
难度: 简单查看答案及解析
-
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该试剂的物质的量浓度为9.2 mol/L
B.该硫酸50 mL若用5 mol/L的氢氧化钠中和,
需要该氢氧化钠溶液100毫升
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的质量分数大于49%
难度: 简单查看答案及解析
-
现有m克某气体,它由双原子分子构成,它的摩尔质量为M克/摩尔。若阿伏加德罗常数用NA表示,则:该气体所含原子总数为___个, 该气体溶于V升水中(不考虑与水反应,水的密度为1 g/cm3),则溶液的质量分数为____;该气体溶于水后形成溶液的密度为d g/cm3,其溶液的物质的量浓度为___。
难度: 简单查看答案及解析
-
氢气在氯气中燃烧,火焰呈________色,瓶口有________ 。氯化氢在水溶液中的电离方程式为________。工业上常用氯气和氢气燃烧的方法制取氯化氢气体,由于氯气有毒,因此燃烧管的内管应该通入的气体是________。
难度: 简单查看答案及解析
-
有X、Y、Z三种元素 ① X、Y、Z的单质在常温下均为气体;② X单质可以在Z单质中燃烧,生成物为XZ,其中火焰为苍白色;③ XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试液变红;④ 每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中所得溶液具有漂白作用。请回答:X+和Z-电子式为________、,化合物X2Y属于________(填电解质、非电解质、强、弱电解质),写出X2Y(写化学式)的电离方程式________。
难度: 简单查看答案及解析
-
用自来水养鱼时,应先将水放一段时间,目的是 。化学方程式为 、________。
难度: 简单查看答案及解析