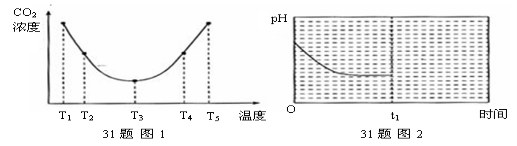
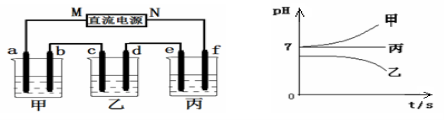
-
下列说法正确的是( )
A.乙烷和乙烯均可使酸性KMnO4溶液褪色
B.纤维素、淀粉和蛋白质都是高分子化合物
C.煤的干馏和石油的分馏均属化学变化
D.酯类和糖类均能发生水解反应
难度: 中等查看答案及解析
-
在水溶液中能大量共存的一组离子是( )
A.Al3+、Na+、HCO3-、SO42- B.H+、Fe2+、ClO-、Cl-
C.Na+、Ag+、Cl-、SO42- D.K+、Ba2+、NO3-、Cl-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.10gNH3含有4NA个电子
B.0.1mol铁和0.1mol铜分别与0.1 mol氯气完全反应,转移的电子数均为0.2NA
C.标准状况下,22.4 L H2O中分子数为NA 个
D.1L 0.1 mol·L-1Na2CO3 溶液中含有 0.1NA个CO32-
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
选项 叙述I 叙述II
A 氯气具有强还原性 可用于自来水的消毒杀菌
B SiO2导电能力强 可用于制造通讯光缆
C 常温下铝在浓硫酸中钝化 常温下可用铝制容器盛放浓硫酸
D Na2S还原性强 用于除去废水中的Cu2+和Hg2+
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )
A.元素Y和元素Z的最高正化合价相同
B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z)
C.气态氢化物稳定性:X <Y<Z<W
D.元素W的最高价氧化物对应的水化物是强酸
难度: 中等查看答案及解析
-
下列过程中不涉及氧化还原反应的是( )
A.用SO2漂白纸浆和草帽辫
B.用氯化铁溶液腐蚀印刷线路板上的铜膜
C.用牺牲阳极的阴极保护法防止金属被腐蚀
D.高温下用焦炭还原SiO2制取粗硅
难度: 中等查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 目的 分离方法 原理
A 使用CCl4提取碘水中的碘 萃取分液 碘在CCl4中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KNO3固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+)
C.常温下,向NH4Cl溶液中加入氨水至溶液的pH=7,此时溶液中c(NH4+)>c(C1-)
D.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
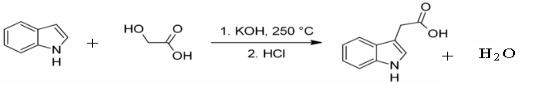
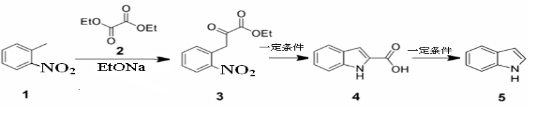
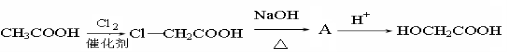
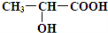 ,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件):
,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件):