-
宇航员翟志刚成功完成的中国历史上首次太空行走,使中国成为第三个独立掌握出舱活动技术的国家.宇航员出舱时,呼吸所需的氧气主要来自太空服中的呼吸面具.下列物质在一定条件下均能产生氧气,其中最适宜用于呼吸面具中供氧剂的是( )
A.HNO3
B.H2O2
C.KClO3
D.Na2O2难度: 中等查看答案及解析
-
在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是( )
A.9:4
B.1:1
C.7:6
D.6:7难度: 中等查看答案及解析
-
把一小块金属钠放入下列溶液中,既能产生气体又会生成白色沉淀的是( )
A.稀硫酸
B.氢氧化钾稀溶液
C.硫酸铜溶液
D.氯化镁溶液难度: 中等查看答案及解析
-
将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2②Na2O③Na2CO3④NaCl( )
A.①>②>③>④
B.①>②>④>③
C.①=②>③>④
D.①=②>③=④难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1
C.32g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L难度: 中等查看答案及解析
-
著名化学家、诺贝尔奖获得者西博格博士1979年在美国化学会成立100周年大会上的讲话中指出“化学是人类进步的关键”.下列对化学的认识不正确的是( )
A.英国科学家道尔顿1661年提出化学元素的概念,标志着近代化学的诞生
B.化学是在原子、分子水平上认识物质的组成、结构、性质、变化、制备和应用的自然科学
C.化学既是一门具有创造性的科学,还是一门具有实用性的科学
D.现代化学还将在能源与资源、材料科学、环境科学、医药与健康等领域产生广泛的影响难度: 中等查看答案及解析
-
向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一块绿豆大小的金属钠,可能观察到的现象符合下图中的( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
9.2g金属钠投入到足量的H2O中,则产生的气体中含有( )
A.0.2mol中子
B.0.4mol电子
C.0.2mol质子
D.0.4mol分子难度: 中等查看答案及解析
-
实验表明:将氯水滴加到一片蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不 正确的是( )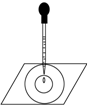
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色外环呈红色或浅红色
C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快
D.氯水中形成次氯酸的反应中还原产物是HClO难度: 中等查看答案及解析
-
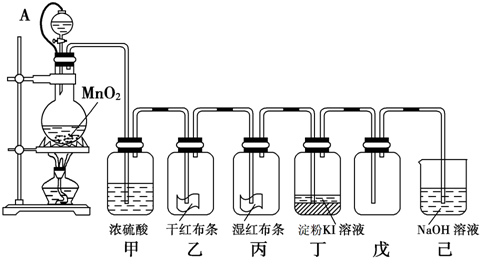
实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是(气体体积在标准状况下测定)( )
A.若提供0.4molHCl,MnO2不足量,则可制得氯气2.24L
B.若提供0.4molHCl,MnO2过量,则可制得氯气2.24L
C.若有0.4molHCl参与反应,则可制得氯气2.24L
D.若有0.4molHCl被氧化,则可制得氯气2.24L难度: 中等查看答案及解析
-
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计).其中能表示等质量的氢气与氦气的是( )
A.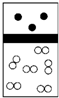
B.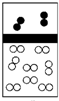
C.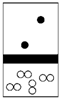
D.难度: 中等查看答案及解析
-
在相同的温度和压强下,4个容器中分别装有4种气体.已知各容器中的气体和容器的容积分别是a.CO2,100mL;b.O2,200mL;c.N2,400mL;d.CH4,600mL,则4个容器中气体的质量由大到小的顺序是( )
A.a>b>c>d
B.b>a>d>c
C.c>d>b>a
D.d>c>a>b难度: 中等查看答案及解析
-
在一定条件下,16g A恰好能跟20g B完全反应,生成C和4.5g D;若在相同条件下,将 8g A和15g B反应时,则生成D和0.125mol的C,则物质C的摩尔质量是( )
A.252g•mol-1
B.168g•mol-1
C.126g•mol-1
D.36g•mol-1难度: 中等查看答案及解析
-
下列关于物质的量浓度表述正确的是( )
A.0.3mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9mol•L-1
B.当1L水吸收22.4L氨气时所得氨水的浓度不是1mol•L-1,只有当22.4L(标况)氨气溶于水制得1L氨水时,其浓度才是1mol•L-1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.10℃时,100ml0.35mol/L的KCl饱和溶液蒸发掉5g水,冷却到10℃时,其体积小于100ml,它的物质的量浓度仍为0.35mol/L难度: 中等查看答案及解析
-
下列说法中错误的是( )
A.从1L1mol•L-1的NaCl溶液中取出10mL,其浓度仍是1mol•L-1
B.制成0.5L1mol•L-1的盐酸,需要氯化氢气体11.2L(标准状况)
C.0.5L2mol•L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.配制2.0mol/L的盐酸时,将量取的浓盐酸放入容量瓶中加水稀释难度: 中等查看答案及解析
-
某实验小组配制了0.2mol•L-1的NaOH的溶液备用,下列保存方法正确的是( )
A.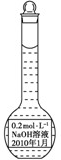
B.
C.
D.
难度: 中等查看答案及解析