-
下列有关化学用语使用正确的是( )
A. 硫离子的价层电子排布式1s22s22p63s23p6
B.中子数为18的氯原子结构示意图:
C.聚乙烯的结构简式:
n
D. NaHSO3在水溶液中的电离方程式:NaHSO3
Na++H++SO32-
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.过量SO2通入Ba(NO3)2溶液3SO2+2NO3-+3Ba2++2H2O===3BaSO4+2NO+4H+
B.1mol的Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2
C.甲醛溶液中加入足量的银氨溶液并加热:
HCHO+2[Ag(NH3)2]++2OH-
HCOO-+NH4++2Ag↓+3NH3+H2O
D.向硫酸铝铵矾溶液中滴加过量的氢氧化钡溶液:
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
难度: 中等查看答案及解析
-
下列物质的除杂方法中,合理的是( )
①SO2中混有的SO3杂质可以让混合气体通过浓硫酸除去;②K2CO3中混有的少量NaHCO3,可以用加热的方法除去;③乙烯中混有的SO2气体可以通过溴水除去;④金属铜中含有的少量银和锌可以通过电解精炼的方法除去;⑤KNO3中含有的少量NaCl可以通过重结晶的方法除去。
A.①②④ B. ①④⑤ C. ①②④⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
关于阿伏伽德罗常数NA,下列说法正确的是( )
A.常温常压下,1mol白磷中含有共价键为4NA
B.标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子
C.常温常压下,46g NO2、N2O4混合物中,分子数为NA
D.1L1mol/L Na2CO3溶液中,阴离子个数大于NA
难度: 中等查看答案及解析
-
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是① K+、Cl-、NO3-、S2- ②Na+、AlO2-、Cl-、SO42- ③ Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- ⑥Fe3+、Ca2+、Cl-、NO3-A.①③⑥ B.③⑤ C.③④⑤ D.①②
难度: 中等查看答案及解析
-
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是( )
A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol/L
难度: 中等查看答案及解析
-
已知-NH2呈碱性,-CONH2呈中性。分子式均为C7H7O2N的以下有机物,对其性质判断正确的是( )
甲 乙 丙 丁
①甲物质既有酸性又有碱性 ②乙物质只有碱性
③丙物质只有酸性 ④丁物质既不显酸性又不显碱性
A.①②③④ B.①②③ C.①③④ D.①②④
难度: 中等查看答案及解析
-
下列各项中表达正确的是( )
A.H2O2的电子式:
B.
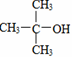 的命名:2,2—二甲基—2—乙醇
的命名:2,2—二甲基—2—乙醇C.常温下,浓度都为0.1mol·Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者
D.
为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键,是极性分子
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I-
C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
难度: 中等查看答案及解析
-
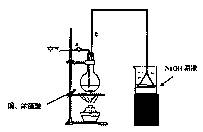
关于下列各装置图的叙述中,正确的是( )




① ② ③ ④
A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是原电池,锌电极为负极,发生还原反应
难度: 中等查看答案及解析
-
盐酸乙哌立松片是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧张状况,其结构筒式如下:关于盐酸乙哌立松片有下列说法: ( )
①是芳香族化合物
②含有N原子的六元环上所有原子均处于同一平面
③能发生还原反应
④是一种有机盐。其中正确的是
A.①③④ B.①②③ C.①②④ D.②③④
难度: 中等查看答案及解析
-
下列化学用语或表达式正确的是 ( )
A.Na+的电子排布式:1S22S22P6
B.乙烯的结构简式CH2CH2
C.N原子最外层轨道表示式:
D.
难度: 中等查看答案及解析
-
用Pt电极电解含有各0.1mol的Cu2-和X3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n (mol)的关系见图示。
则离子的氧化能力由大到小排列正确的是: ( )
A.Cu2+>X3+>H+ B.Cu2+>H+>X3+
C.X3+>H+>Cu2+ D.H+>X3+>Cu2+
难度: 中等查看答案及解析
-
关于下列图示的说法中正确的是 ( )

A.图①表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0
B.图②为电解硫酸铜溶液的装置,一定时间内两电极产生单质的物质的量之比一定为1:1
C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
D.图④量取0.10 mol·L-1KMnO4溶液20.00mL
难度: 中等查看答案及解析
-
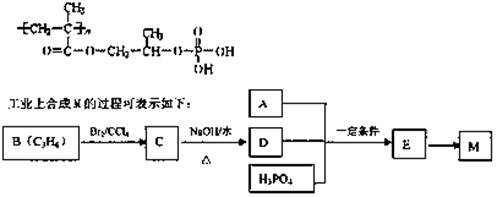
A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素x,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列说法中正确的是 ( )
A.X元素可能为铝或硅
B.反应①和②互为可逆反应
C.反应①和②一定为氧化还原反应
D.X元素可能是金属,也可能是非金属
难度: 中等查看答案及解析
-
下列有关除杂质(括号中为杂质)的操作中,错误的是 ( )
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.苯(苯酚):加溴水,振荡,过滤除去沉淀
C.溴乙烷(乙醇):多次加水振荡,分液,弃水层
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
难度: 中等查看答案及解析
-
三氯生是一种抗菌剂,其结构如图所示,遇含氯自来水能生成有毒的三氯甲烷。下列说法不正确的是 ( )
A.1 mol三氯生最多能与6mol H2反应
B.三氯生的分子式是C12H6Cl3O2
C.三氯甲烷与甲烷均无同分异构体
D.1 mol三氯生最多能与7 moI NaOH反应
难度: 中等查看答案及解析
-
在1 100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是 ( )
A.若生成1 mol Fe,则吸收的热量小于akJ
B.若要提高CO的转化率,则应该加入适当的过量Fe0
C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D.达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
难度: 中等查看答案及解析