-
(12分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
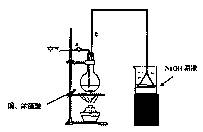
(1)烧杯中用NaOH溶液吸收的物质是:________(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:________。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:________。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的________(填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行____________、________、________后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是________。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:________,
________。
-
(14分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
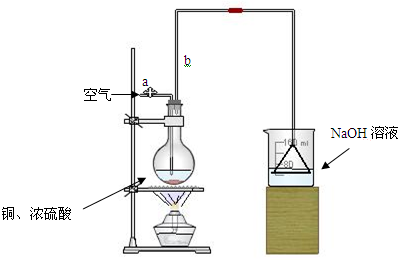
(1)首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
(2)烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
(3)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的 (填仪器名称)起到了确保硫酸体积保持不变的作用。
(4)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
(5)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析: (填“需要”或“不需要”)加入双氧水,原因: 。
-
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
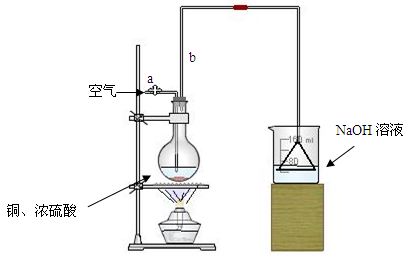
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行________操作。
⑵烧杯中用NaOH溶液吸收的物质是:________(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:________。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:________。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
________(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行________、________、________后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是________。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:________
________。
-
(12分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
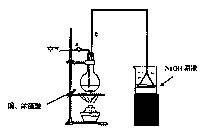
(1)烧杯中用NaOH溶液吸收的物质是:________(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:________。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:________。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的________(填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行____________、________、________后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是________。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:________,
________。
-
某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.
请根据实验回答问题:
(1)首先根据图所示,组装实验装置,并在加入试剂前先进行 操作.
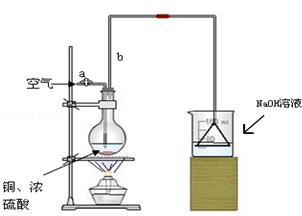
(2)烧杯中用NaOH溶液吸收的物质是 (填化学式),利用倒置的漏斗而不是将导气管直接伸入烧杯中的目的是: .
(3)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: .待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全.然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中.在该实验装置中的 (填仪器名称)起到了确保硫酸溶液体积保持不变的作用.
(4)将充分反应后的烧杯取下,向其中加入足量的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量固体的质量为13.98g,请计算能与铜反应的硫酸的最低浓度是 .
(5)有同学提出在上面(4)中可以不必加入双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析 (填“需要”或“不需要”)加入双氧水,说明原因: .
-
某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3: 。
【实验验证】
实验装置及实验中使用的试剂如图:
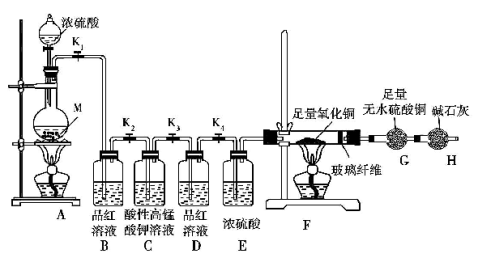
(1)在装入药品前,甲同学检查装置A 的气密性,方法是 。
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设 ,理由是 。
(3)如果实验中观察到装置B 中溶液褪色,装置F 和装置G 中无明显变化,则假设 成立,实验测得消耗金属M 和浓硫酸的物质的量之比为1∶2,则在M 的硫酸盐中,M 元素的化合价为 。
(4)如果假设3 正确,填写下表中的实验现象:
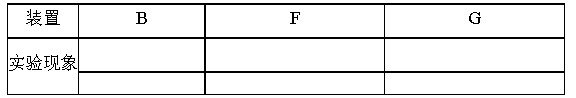
(5)装置C 的作用是 ,装置D 的作用是 。
(6)如果装置A 中放入的金属M 的质量为11.2 g,加入适量浓硫酸,反应完成后,装置B中溶液褪色,装置A 中金属无剩余;反应后G 的质量增加了0.9 g;取少量装置A 中溶液稀释,分为两份,一份滴加KSCN 溶液,溶液变红色,另一份滴加酸性KMnO4 溶液,溶液褪色。如果装置A 中溶液内的金属离子浓度相等,则装置A 中烧瓶内发生反应的总化学方程式是 。
-
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为________.
(2)这样制取的二氧化硫气体中可能含有的杂质是________;原因是________.
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________(用a、b…填写).
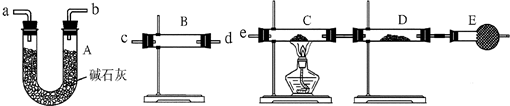
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ________ | ________ | ________ |
| C | CuO固体 | ________ | ________ |
-
某课外活动小组的同学在学习了电化学相关知识后,用如图装置进行实验,请回答下列问题:
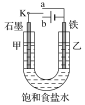
(1)实验一:将开关K与a连接,则乙为_____极,电极反应式为______。
(2)实验一结束后,该研究小组的同学决定在乙电极表面上镀下列金属中的一种以防止铁被腐蚀,正确的选择是____(填字母编号)。
A.Cu B.Zn C.Sn D.Ag
(3)实验二:开关K与b连接,则乙__极,总反应的离子方程式为______。
(4)对于实验二,下列说法正确的是____(填字母编号)。
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.反应在结束后,甲电极和乙电极上收集到的气体体积一定相等
(5)该研究小组的同学在进行实验二结束的溶液中滴加酚酞溶液,发现________(填“甲”或“乙”)极附近变红。
-
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为______________________________。
(2)这样制取的二氧化硫气体中可能含有的杂质是__________________;原因是________________________________________________________________________________________________________________________________________________。
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________(用a、b……填写)。
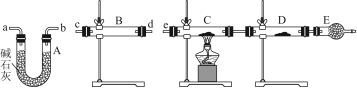
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | | | |
| C | CuO固体 | | |
-
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为___________ ______________________。
(2)这样制取的二氧化硫气体中可能含有的杂质是____________________________;原因是_______________________________________________________。
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________(用a、b……填写)。
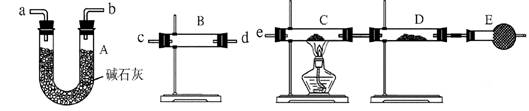
(4) 根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | | | |
| C | CuO固体 | | |










