-
“吃尽百味还点盐,穿尽绫罗不如棉”。食盐不仅是调味品,更在医药、化工等领域有广泛应用。下列有关叙述中正确的是
A. 食盐熔化时因离子键遭破坏故属化学变化 B. 电解饱和食盐水可制备金属钠
C. 生理盐水的浓度越接近饱和药效越好 D. 加碘食盐中的碘以 IO3- 形成存在
难度: 简单查看答案及解析
-
下列表示含硫物质的化学用语正确的是
A. NaHSO3电离: NaHSO3= Na++H++SO32- B. Na2S 电子式:
C. 标准状况下密度为 8.57g/L 的硫蒸汽:S6 D. 中子数为 17 的硫原子:
难度: 简单查看答案及解析
-
下列各物质所属类别的判断均正确的一组是
混合物
碱
盐
碱性氧化物
酸性氧化物
A
液氨
苛性钠
胆矾
氧化铁
二氧化碳
B
纯盐酸
烧碱
食盐
氧化钠
二氧化氮
C
8﹒4消毒液
纯碱
石灰石
氨气
水
D
聚乙烯塑料
熟石灰
苏打
生石灰
二氧化硫
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 胶体区别于其他分散系的本质特征是丁达尔效应
B. 氧化还原反应的特征是元素化合价发生了变化
C. 液态氯化氢不导电说明氯化氢是非电解质
D. 碳酸钠固体溶于水放热说明碳酸钠的水解反应放热
难度: 简单查看答案及解析
-
下列有关物质的性质与应用相对应的是
A. 浓盐酸具有氧化性,可作为实验制氯气的原料 B. SO2具有还原性,可用来漂白品红
C. NH3具有碱性, 可用氨水吸收硫酸厂尾气 D. 氢氟酸具有酸性,可用于雕刻玻璃
难度: 简单查看答案及解析
-
设 NA为阿伏加德罗常数的值,下列说法中正确的是
A. 常温常压下, 8.96 L Cl2全部溶于水后转移电子的数目为 0.4NA
B. 0.2 mol·L-1 Na2SO4溶液中 Na+数目为 0.4 NA
C. 100 g 质量分数为 9.8%的 H2SO4水溶液中含氧原子数目为 0.4NA
D. 标准状况下, 2.24 L NH3含原子数目为 0.4 NA
难度: 简单查看答案及解析
-
下列指定反应的离子方程式书写正确的是
A. 用氯化铁溶液腐蚀铜板: Cu + Fe3+ = Cu2+ + Fe2+
B. 将铜片插入稀硝酸中: 3Cu + 8H+ + 2NO3-= 3Cu2+ + 2NO↑ + 4H2O
C. 向 NH4HCO3溶液中加过量 NaOH 溶液并加热: NH4 ++ OH- = NH3↑+ H2O
D. 向 NaAlO2 溶液中通入过量的 CO2: 2AlO2-+ CO2 + 3H2O = Al(OH)3↓ + 2CO32-
难度: 中等查看答案及解析
-
实验室将NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧得Al2O3,下列图示装置和原理均能达到实验目的的是
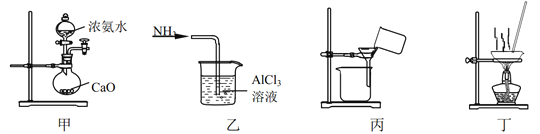
A. 用装置甲制取 NH3 B. 用装置乙制备 Al(OH)3
C. 用装置丙过滤并洗涤 Al(OH)3 D. 用装置丁灼烧 Al(OH)3得 Al2O3
难度: 中等查看答案及解析
-
在给定条件下,下列各组离子一定能大量共存的是
A. pH=2的溶液中:K+、Mg2+、I-、SO32-
B. 在含大量 Fe3+的溶液中:NH4+、Na+、 Cl-、 NO3-
C. 与 Al 反应放出氢气的溶液中:K+、Na+、Cl-、HCO3-
D. I-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、MnO4-
难度: 中等查看答案及解析
-
下列关于焓变(ΔH)的叙述或判断中错误的是

A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的 ΔH<0
B. 500 ℃、30 MPa下,0.5 mol N2和1.5 mol H2充分反应放出 19.3 kJ 热量,则反应“N2(g)+3H2(g)
2NH3(g)”的 ΔH=-38.6 kJ·mol-1
C. 据下图1 知:ΔH1 = ΔH2+ΔH3
D. 据下图2 知:E的大小对该反应的ΔH 无影响
难度: 中等查看答案及解析
-
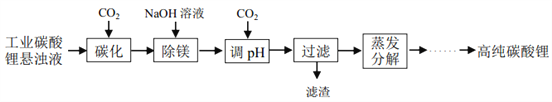
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
Li2NH+H2 = LiNH2+LiH。下列有关说法正确的是
A. Li2NH中H的化合价是+1 B. 该反应中 H2是还原剂,Li2NH 是氧化剂
C. H-离子的半径大于 Li+ D. 此法储氢和钢瓶储氢的原理相同
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现并与工业生产相吻合的是
A. NH4Cl
NH3
NO2
HNO3
B. NaCl饱和溶液
NaHCO3
Na2CO3
C. 黄铁矿
SO2
SO3
浓硫酸
D. NaCl(熔融)
Cl2
漂白粉
难度: 中等查看答案及解析
-
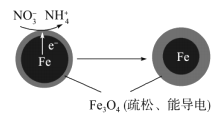
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
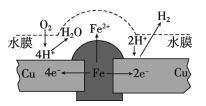
A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流负极相连,则铁铜均难被腐蚀
难度: 中等查看答案及解析
-
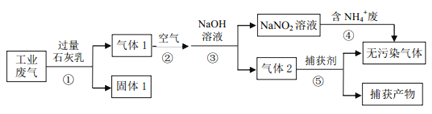
经测定某钠盐溶液中含大量的HCO3-、CO32-、SO32-、SO42-、NO3- 等5种阴离子。已知硝酸盐受热易分解,下列判断正确的是
A. 若向该溶液加入少量的 Na2O2,物质的量不变的离子是SO42-和NO3-
B. 若将该溶液中用盐酸酸化,则产生的气体中一定含有 CO2和 NO
C. 向 B 选项所得溶液中滴加 BaCl2溶液产生白色沉淀, 可证明原溶液中存在 SO42-
D. 若将该溶液蒸干并灼烧至恒重,则所得固体中一定不含 HCO3-、 SO32-、 NO3-
难度: 中等查看答案及解析
-
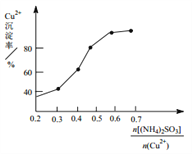
Al2O3与 MgO 的混和物经过量烧碱溶液处理后,过滤,向所得滤液中滴加 NaHCO3溶液,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. a 点溶液中存在的离子有Na+、AlO2-、OH-、H+
B. b点与c点溶液所含微粒种类相同
C. NaHCO3溶液的物质的量浓度为0.8 mol/L
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O = Al(OH)3↓+CO32-
难度: 中等查看答案及解析