-
I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
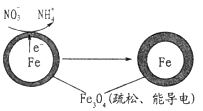
(1)Fe还原水体中NO3-的反应原理如图所示。

正极的电极反应式是 。
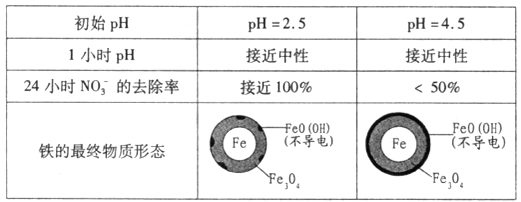
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24 小时pH 小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 
| 
|
pH=4.5时,NO3-的去除率低。其原因是 。
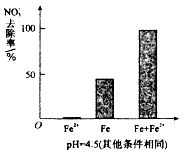
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe 2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层。
2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层。
① 对比实验,结果如图所示,可得到的结论是 。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因: 。
II.高铁酸钠Na2FeO4 是一种新型净水剂。
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH= 2Na2FeO4+3X+5H2O,则X的化学式为__________。
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式 。
-
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
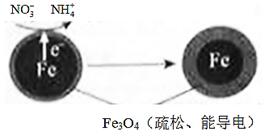
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3—的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 
| 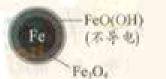
|
pH=4.5时,NO3—的去除率低。其原因是________。
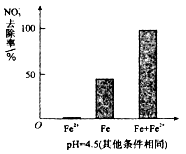
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如右图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
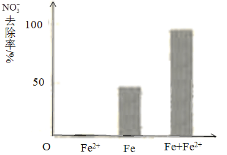
pH =4.5(其他条件相同)
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3—的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
-
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
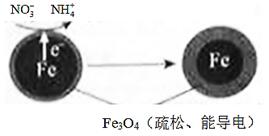
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3—的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 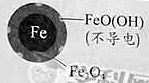
| 
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。

(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3—的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
-
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是_________。
②正极的电极反应式是_________。
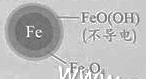
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 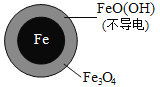
| 
|
pH=4.5时,NO3-的去除率低。其原因是_________。
(3)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_________。
-
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
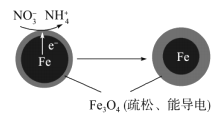
①作负极的物质是__________。
②正极的电极反应式是__________。
(2)将足量铁粉投入水体中,经 24小时测定 NO3-的去除率和pH,结果如下:
| 初始 pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近 100% | <50% |
| 24 小时 pH | 接近中性 | 接近中性 |
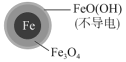
| 铁的最终物质 形态 | 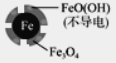
| 
|
pH=4.5 时,NO3-的去除率低,其原因是_____________。
(3)实验发现:在初始 pH=4.5 的水体中投入足量铁粉的同时,补充一定量的 Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏 FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是________。
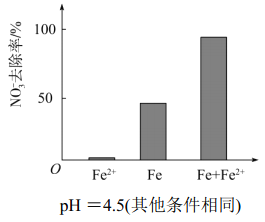
②同位素示踪法证实 Fe2+能与 FeO(OH)反应生成 Fe3O4。结合该反应的离子方程式,解释加入 Fe2+提高NO3-去除率的原因:_____________。
(4) 其他条件与(2)相同,经 1小时测定NO3-的去除率和 pH,结果如下:
| 初始 pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始 pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_______。
-
地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题。用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
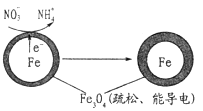
作负极的物质是___________;正极的电极反应式是_____________。
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如下:
在pH =4.5的水体中,NO3-的去除率低的原因是_____________。
(3)为提高pH =4.5的水体中NO3-的去除率,某课题组在初始pH =4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图:
此实验可得出的结论是____,Fe2+的作用可能是_________。(2)中NO3-去除率和铁的最终物质形态不同的原因______________。
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有_______。(写出一条)
-
地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题。用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
作负极的物质是___________;正极的电极反应式是_____________。
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如下:

在pH =4.5的水体中,NO3-的去除率低的原因是_____________。
(3)为提高pH =4.5的水体中NO3-的去除率,某课题组在初始pH =4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图:
此实验可得出的结论是____,Fe2+的作用可能是_________。(2)中NO3-去除率和铁的最终物质形态不同的原因______________。
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有_______。(写出一条)
-
用零价铁(Fe)进行水体脱氮、(去除水体中的NO3-),已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。其中作负极的物质是________,正极的电极反应式是_________。
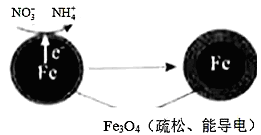
(2)研究表明,零价铁脱氮后最终会在表面生成不导电的FeO(OH)外皮,从而使得脱氮过程停止。补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ. Fe2+破坏FeO(OH)氧化层。
针对假设I:做对比实验,结果如图所示,可得到的结论是_______。

②针对假设II:以同位素示踪法,证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为_______________,加入Fe2+提高NO3-去除率的原因:____________。
(3)将足量铁粉投入水体中,测定不同初始pH对脱氧的影响见下边左图,初始PH为2.5时氮浓度与pH变化见下边图。结合两图分析,不同初始pH对脱氮产生影响的原因为_________________。
-
用零价铁 去除水体中的硝酸盐
去除水体中的硝酸盐 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.

 还原水体中
还原水体中 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定 的去除率和pH,结果如下:
的去除率和pH,结果如下:
| 初始pH | 
| 
|
|  的去除率 的去除率
| 接近 | 
|
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 
| 
|
 时,
时, 的去除率低.其原因是______.
的去除率低.其原因是______.
 实验发现:在初始
实验发现:在初始 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的 可以明显提高
可以明显提高 的去除率.对
的去除率.对 的作用提出两种假设:
的作用提出两种假设:
Ⅰ 直接还原
直接还原 ;
;
Ⅱ 破坏
破坏 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实 能与
能与 反应生成
反应生成 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入 提高
提高 去除率的原因:______.
去除率的原因:______.
 其他条件与
其他条件与 相同,经1小时测定
相同,经1小时测定 的去除率和pH,结果如表:
的去除率和pH,结果如表:
| 初始pH | 
| 
|
|  的去除率 的去除率
| 约 | 约 |
| 1小时pH | 接近中性 | 接近中性 |
与 中数据对比,解释
中数据对比,解释 中初始pH不同时,
中初始pH不同时, 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
-
用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是( )
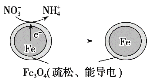
A. 能量转化形式主要为化学能转化为电能
B. 电极材料分别为Fe和Fe3O4
C. 负极反应为NO3-+8e-+10H+===NH4++3H2O
D. 该原理的总反应可表示为NO3-+3Fe+2H++H2O===NH4++Fe3O4


























