-
某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量SiO2、Fe的氧化物)为原料制备碳酸镁晶体(MgCO3•3H2O)。实验过程如下:
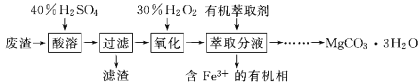
下列说法不正确的是( )
A.为了加快酸溶速率,可将原料进行研磨并适当提高反应温度
B.滤渣的主要成分是H2SiO3和SiO2
C.萃取后,可用KSCN溶液检验水相中是否含有Fe3+
D.萃取后,往水溶液中加入适量的Na2CO3,经过加热蒸发,可得到碳酸镁晶体
-
实验室以一种工业废渣(主要成分为MgCO3、 MgSiO3以及铁和铝的氧化物)为原料制备MgCO3∙3H2O。实验流程如下: [已知当溶液的pH=8.5时, Mg(OH)2开始沉淀]
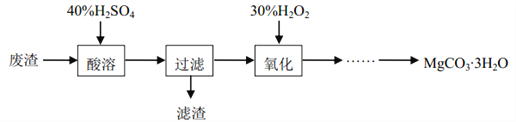
(1)滤渣的主要成分是______(填化学式)。
(2)氧化的目的是__________。
(3)由氧化后得到的溶液经除杂后,滴加适量的Na2CO3溶液便可制得MgCO3∙3H2O。滴加Na2CO3溶液时,不能太快也不能过量的原因是_______________。
(4)通过测定产品中的镁含量和碳含量可判断质量的优劣。现称取3.00 g某学生制得的产品溶于足量的稀盐酸中收集到448 mLCO2气体(假设气体全部逸出并折算为标准状况 ),再将所得溶液稀释至250 mL,取 出25 mL,向其中滴加0.1000 mol·L-1的EDTA(Na2H2Y)溶液至恰好完全反应时消耗体积为23.10 mL。(离子方程式为Mg2++H2Y2-=MgY2-+2H+)通过计算,分别确定镁含量和碳含量比理论值偏高还是偏低?_____。
-
某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:
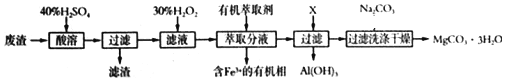
(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+, 萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是_______。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为_____________________。
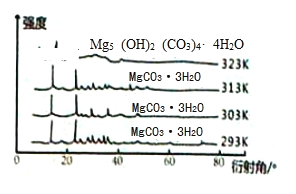
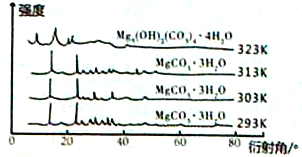
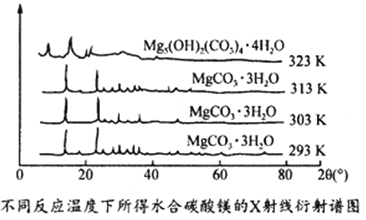
(5)右图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为_______,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。
-
某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:
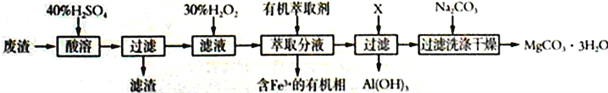
(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+
①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是__________________________。
②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是______________________________。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________,应调节pH的范围为_________________。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5时,Mg(OH)2开始沉淀
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是____________________________。
(6)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。
-
镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
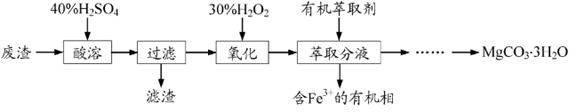
(1)废渣的成分为_________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理_____________________。
(2)加入H2O2的目的是__________________,一段时间后,溶液中有气泡出现并放热,则产生气泡的原因是____________。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并________________。萃取分液的目的是____________。(填序号)
A、除去水溶液中的铁离子
B、增加镁离子在水中的溶解性
C、富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置,________,确定沉淀完全后,过滤、____________,得到MgCO3·3H2O。
-
镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
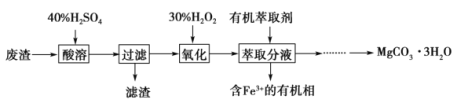
(1)滤渣的成分为_________________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理:______________。
(2)加入H2O2一段时间后,溶液中有气泡出现并放热,分析产生气泡的原因:____________(用文字表达)。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并____________________。萃取分液的目的是______________(填字母)。
A.除去水溶液中的铁离子
B.增加镁离子在水中的溶解度
C.富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置后,进行操作:______________________________,确定沉淀完全后,再过滤、__________________、__________________,得到MgCO3·3H2O。
-
实验室以一种工业废渣(主要成分为MgCO3、MgSO4,含有少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
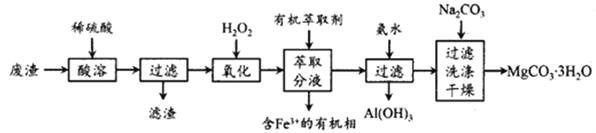
(1)为加快酸溶速率,可采取的办法有______,写出酸溶时废渣中主要成分发生反应的化学方程式为_________________。
(2)加入H2O2氧化时发生发应的离子方程式为_________________。
(3)用萃取分液的方法除去溶液中的Fe3+。
①检验溶液中是否含有Fe3+的最佳试剂是_________________。
②为使Fe3+ 尽可能多地从水相转移至有机相,采取的操作:向水溶液中加入一定量的萃取剂,_______、静置、分液,并重复多次。
③萃取时,向混合溶液(含Fe2+、Al3+、Mg2+)中加入适量盐酸,使Fe2+ 与Cl-生成[FeCl4]-,再用足量的乙醚(Et2O)进行萃取,乙醚与H+结合,生成了离子Et2O·H+,由于[FeCl4]-与Et2O·H+离子容易形成缔合物Et2O·H+·[FeCl4]-。该缔合物中,Cl-和Et2O分别取代了Fe2+和H+的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。因此,就从水相转移到有机相中。该萃取剂不能萃取Al3+、Mg2+的原因是_________。
(4)已知:Ksp[Al(OH)3]=1.0×10-33,Ksp[(Mg(OH)2)=1.0×10-12.pH=8.5时Mg(OH)2开始沉淀。室温下,除去MgSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需加入氨水调节溶液pH的范围为____________。
(5)向滤液中加入Na2CO3溶液生成MgCO3 沉淀并用蒸馏水洗涤,检验沉淀是否洗净的操作是________________。
(6)干燥时需低温干燥,温度较高时发生副反应,写出MgCO3·3H2O在323K温度时发生转化的化学方程式________________。

-
实验室以一种工业废渣(主要成分为MgCO3、MgSO4,含有少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
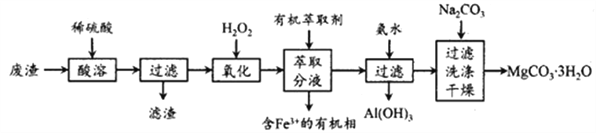
(1)为加快酸溶速率,可采取的办法有______,写出酸溶时废渣中主要成分发生反应的化学方程式为_________________。
(2)加入H2O2氧化时发生发应的离子方程式为_________________。
(3)用萃取分液的方法除去溶液中的Fe3+。
①检验溶液中是否含有Fe3+的最佳试剂是_________________。
②为使Fe3+ 尽可能多地从水相转移至有机相,采取的操作:向水溶液中加入一定量的萃取剂,_______、静置、分液,并重复多次。
③萃取时,向混合溶液(含Fe2+、Al3+、Mg2+)中加入适量盐酸,使Fe2+ 与Cl-生成[FeCl4]-,再用足量的乙醚(Et2O)进行萃取,乙醚与H+结合,生成了离子Et2O·H+,由于[FeCl4]-与Et2O·H+离子容易形成缔合物Et2O·H+·[FeCl4]-。该缔合物中,Cl-和Et2O分别取代了Fe2+和H+的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。因此,就从水相转移到有机相中。该萃取剂不能萃取Al3+、Mg2+的原因是_________。
(4)已知:Ksp[Al(OH)3]=1.0×10-33,Ksp[(Mg(OH)2)=1.0×10-12.pH=8.5时Mg(OH)2开始沉淀。室温下,除去MgSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需加入氨水调节溶液pH的范围为____________。
(5)向滤液中加入Na2CO3溶液生成MgCO3 沉淀并用蒸馏水洗涤,检验沉淀是否洗净的操作是________________。
(6)干燥时需低温干燥,温度较高时发生副反应,写出MgCO3·3H2O在323K温度时发生转化的化学方程式________________。
-
实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
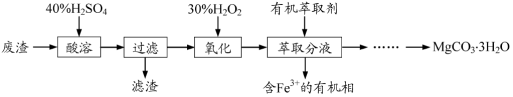
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是_____ _;所加H2SO4不宜过量太多的原因是____ __。
(2)加入H2O2氧化时发生发应的离子方程式为__________
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
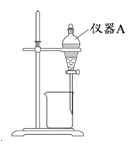
①实验装置图中仪器A的名称为__________。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
-
实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2 (g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是_________;所加H2SO4不宜过量太多的原因是__________。
(2)加入H2O2氧化时发生发应的离子方程式为__________
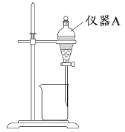
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______ 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,____________________________________________________________ ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。[已知该溶液中pH=8.5时Mg(OH) 2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。















