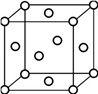
-
物质的性质决定其用途。下列说法正确的是
A. 二氧化氯具有强氧化性,可用来漂白织物
B. 氯化铝是强电解质,可电解其水溶液获得金属铝
C. 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
D. 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
难度: 中等查看答案及解析
-
化学与环境、材料、能源等关系密切。下列说法正确的是
A. 焚烧废旧塑料以防止“白色污染”
B. 大量CO2排放可导致酸雨的形成
C. 积极开发风力、太阳能发电,改善能源结构
D. 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 质量数为35的氯原子:
B. NH4Cl的电子式:
C. NaHCO3的水【解析】
HCO3—+H2OCO32—+H3O+
D. 天然橡胶的结构简式:
难度: 简单查看答案及解析
-
W、R、X、Y、Z是原子序数依次增大的短周期主族元素。Y原子半径在短周期主族元素中最大。W与Y同主族,X与Z同主族。R原子最外层电子数比内层电子数多3,W、Y原子的电子数总和与X、Z原子的电子数总和之比为1∶2。下列说法正确的是
A. 原子半径: r(X)>r(R)>r(W)
B. X与Y只能形成一种化合物
C. X的简单气态氢化物的热稳定性比Z的弱
D. 由W、R、X三种元素组成的化合物可以是酸、碱或盐
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 漂白粉溶液在空气中失效:ClO—+CO2+H2O==HClO+HCO3—
B. 银氨溶液中滴加过量的盐酸:Ag(NH3)2++2H+==Ag++2NH4+
C. 过量的铁粉与稀硝酸反应:3Fe+2NO3—+8H+ == 3Fe2++2NO↑+4H2O
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO—+2Fe(OH)3==2FeO42—+3Cl—+H2O+4H+
难度: 中等查看答案及解析
-
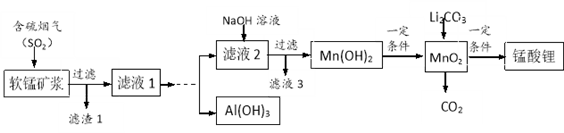
下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是
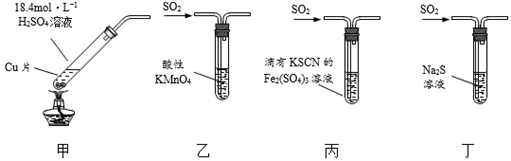
A. 用图甲装置制取SO2
B. 图乙装置中溶液的颜色变浅,说明SO2具有漂白性
C. 图丙装置中溶液的颜色变浅,说明SO2具有还原性
D. 图丁装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性
难度: 中等查看答案及解析
-
以熔融Na2CO3为电解质,H2和CO混合气为燃料的电池原理如下图所示。

下列说法正确的是
A. b是电池的负极
B. a电极的反应为:CO+CO32ˉ-2eˉ== 2CO2;H2+CO32ˉ-2eˉ== H2O+CO2
C. a电极上每消耗22.4L原料气,电池中转移电子数约为2╳6.02╳1023
D. a、b两极消耗的气体的物质的量之比是1︰1
难度: 中等查看答案及解析
-
已知:①4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH1=-905.5kJ·molˉ1
②N2(g)+O2(g)
2NO(g) ΔH2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下:
③4NH3(g)+4NO(g)+O2(g)
4N2(g)+6H2O(g) ΔH3=-1625.5 kJ·molˉ1。

下列说法正确的是
A. 反应①使用催化剂,ΔH1减小
B. 反应②生成物总能量低于反应物总能量
C. 反应③一定能自发进行
D. 反应③达到平衡后升高温度,v(正)、v(逆)的变化如右图所示
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能一步实现的是
A. NaAlO2 (aq)
Al(OH)3
Al
B. CaSO4(s)
CaCO3(s)
(CH3COO)2 Ca(aq)
C. Fe2O3
FeCl3(aq)
无水FeCl3
D. NaCl(aq)
NaHCO3
Na2CO3
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是

图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
难度: 中等查看答案及解析
-
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如下图所示),下列说法正确的是

A.分子A中所有碳原子均位于同一平面
B.用FeCl3溶液可检验物质B中是否混有A
C.物质B既能发生银镜反应,又能发生水解反应
D.1mol B最多可与5mol H2发生加成反应
难度: 困难查看答案及解析
-
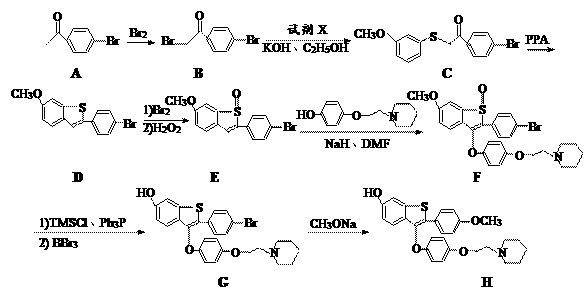
孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的一组离子正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、H+、Cu2+、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
将气体X分别通入溴水和酸性高锰酸钾溶液中,两溶
液均褪色
气体X一定是C2H4
B
向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀
AlO2—结合H+的能力比CO32—强
C
向某溶液中先滴加少量氯水,再滴加2滴KSCN溶液,溶液变成血红色
原溶液中一定含有Fe2+
D
将H2S气体通入浓度均为0.01mol·L—l的ZnSO4和CuSO4混合溶液中,先出现CuS黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是
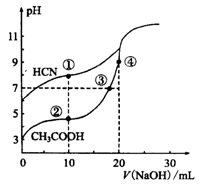
A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
难度: 简单查看答案及解析
-
α-氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为:

在T℃时,向2.0 L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min
0
1
2
5
10
n(HCl)/mol
0
0.12
0.20
0.32
0.32
下列有关说法正确的是
A. 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol·L-1·min-1
B. 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH>0
C. 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 mol α-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行
D. 在T℃时,起始时若向容器中充入2.0molα-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20%
难度: 中等查看答案及解析