-
对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
向盐酸中加入浓硫酸时,会有白雾产生。下列叙述不属于导致产生该现象的原因是
A. 浓硫酸有吸水性 B. 盐酸有挥发性
C. 气态溶质的溶解度随温度开高而降低 D. 浓硫酸有脱水性
难度: 中等查看答案及解析
-
Cl2和SO2都具有漂白作用,能使品红溶液褪色。若将等物质的量的Cl2、SO2混合再通入品红与BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①② B.①③
C.②③ D.②④
难度: 简单查看答案及解析
-
配置一定物质的量浓度的硫酸溶液,必须使用的仪器是( )
A. 锥形瓶 B. 容量瓶 C. 电子天平 D. 漏斗
难度: 简单查看答案及解析
-
25℃时,0.01 mol/L氢氧化钠溶液的pH是( )
A. 12 B. 9 C. 5 D. 2
难度: 简单查看答案及解析
-
下列关于实验室制取NH3的叙述正确的是( )
A. 用N2和H2作反应物 B. 用无水氯化钙进行干燥
C. 用向上排空气法收集 D. 用蘸有浓盐酸的玻璃棒验满
难度: 中等查看答案及解析
-
反应4CO(g)+2NO2(g)
N2(g)+4CO2(g)开始进行时,CO的浓度为4 mol·L-1,N2的浓度为0,2 min后测得N2的浓度为0.6 mol·L-1,则此段时间内,下列反应速率表示正确的是( )
A. v(CO2)=1.2 mol·(L·min)-1 B. v(NO2)=0.3 mol·(L·min)-1
C. v(N2)=0.6 mol·(L·min)-1 D. v(CO)=1.2 mol·(L·s)-1
难度: 中等查看答案及解析
-
在密闭容器中发生化学反应H2(g)+I2(g)⇌2HI(g),0∼5min内H2的浓度减少了0.1mol/L,则在这段时间内,用HI表示的平均反应速率为( )
A.0.01mol•L-1•min-1 B.0.2mol•L-1•min-1
C.0.04mol•L-1•min-1 D.0.5mol•L-1•min-1
难度: 中等查看答案及解析
-
密闭容器中反应CO(g) +H2O(g)
CO2(g) + H2(g)达到平衡,在其他条件不变的情况下,下列措施不能使正反应速率加快的是 ( )
A、通入水蒸气 B、 缩小容器体积 C、分离出CO2 D、升高温度
难度: 中等查看答案及解析
-
将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b g ( a>b )粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
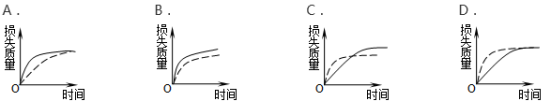
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组溶液同时开始反应,最先出现浑浊现象的是( )
组
别
反应
温度
(℃)
反应物
加水
体积
(ml)
Na2S2O3
H2SO4
体积
(ml)
浓度
(mol/L)
体积
(ml)
浓度
(mol/L)
A
40
5
0.2
5
0.1
10
B
10
10
0.1
10
0.1
0
C
10
5
0.1
5
0.2
10
D
40
5
0.2
5
0.2
10
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
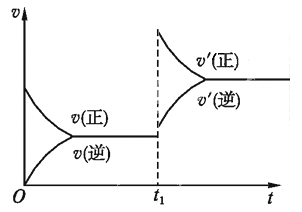
一定温度下,对于可逆反应N2(g) +3H2(g)
2NH3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是( )
A. 恒容容器内混合气体的密度不再变化
B. NH3的生成速率与H2的生成速率之比为2:3
C. 恒压容器内混合气体的总物质的量不再变化
D. 单位时间内断裂a mol N三N键,同时断裂6amol N-H键
难度: 中等查看答案及解析
-
在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)
CH3OH(g)+Q(Q>0).第2 min时只改变一个条件,反应情况如下表
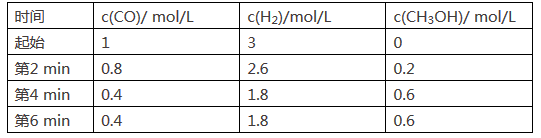
下列说法不正确的是 ( )
A. 第4 min至第6 min该化学反应处于平衡状态
B. 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C. 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D. 第6 min时,其他条件不变,如果升高温度,正反应速率增大
难度: 中等查看答案及解析
-
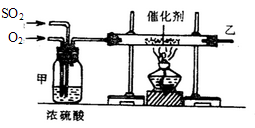
下列关于硫酸工业生产过程的叙述错误的是( )
A.在接触室中使用铁粉作催化剂
B.在接触室中运用热交换技术可充分利用能源
C.把硫铁矿磨成细粉末,可以提高原料的利用率
D.该反应采用450~500°C主要是因为该温度下催化剂活性好
难度: 简单查看答案及解析
-
下列事实能用勒夏特列原理解释的是( )
A. 紫色石蕊试液遇酸变为红色
B. 使用铁触媒,可加快合成氨反应速率
C. 合成氨工业采用500℃的高温进行生产
D. 一定条件下2HI(g)
H2(g)+I2(g)达平衡后,压缩体系的容器,颜色迅速变深
难度: 中等查看答案及解析
-
以下是几位同学在学习了化学反应速率和化学平衡理论以后发表的一些看法,其中不正确的是( )
A. 化学反应速率理论可指导怎样在一定时间内快出产品
B. 化学平衡理论可指导怎样使用有限原料多出产品
C. 化学反应速率理论可指导怎样提高原料的转化率
D. 化学平衡理论是研究怎样使原料尽可能多地转化为产品
难度: 简单查看答案及解析
-
据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g)下列叙述不正确的是
A.使用CuZnFe催化剂可大大提高生产效率
B.恒容时,充入大量CO2气体可提高H2的转化率
C.反应需在300 ℃时进行可推测该反应是吸热反应
D.从平衡混合气体中及时分离出CH3CH2OH和H2O可提高CO2和H2的利用率
难度: 中等查看答案及解析
-
对于合成氨反应,达到平衡后,以下分析正确的是( )
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
难度: 中等查看答案及解析
-
一定条件下反应mA(g)+ nB(g)
pC(g)+qD(g)在一密闭容器中进行,测得平均反应速度v(C)= 2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是 ( )
A. 2、6、3、5 B. 3、1、2、1 C. 1、3、2、2 D. 3、1、2、2
难度: 中等查看答案及解析