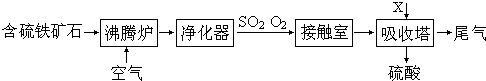
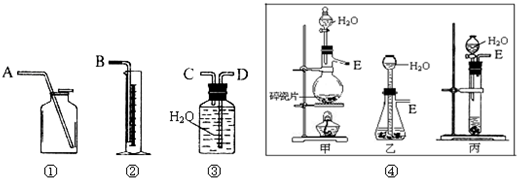
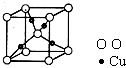
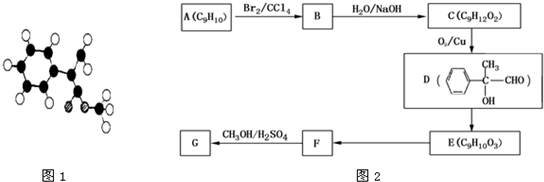
-
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)⇌nY(g);△H=Q kJ/mol.反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
下列说法正确的是( )/L积体气温体c(Y)/mol•L-1度/℃ 1 2 3 100 1.00 0.75 0.53 200 1.20 0.90 0.63 300 1.30 1.00 0.70
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动难度: 中等查看答案及解析
-
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20mL0.01mol/L氨水中的Ksp比在20mL0.01mol/LNH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2难度: 中等查看答案及解析
-
下列应用化学学科研究物质性质的基本方法或所得结论中,不正确的是( )
A.根据物质的元素组成,将纯净物分为单质和化合物
B.通过钠、镁、铝与水反应的实验,比较三种单质的金属性
C.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应
D.打开盛装浓氨水的试剂瓶塞,观察现象,了解氨的某些物理性质难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.乙烯可使酸性高锰酸钾溶液褪色,则丙烯也可使其褪色
B.人造纤维,合成纤维和光导纤维都是有机高分子化合物
C.加热能杀死猪流感病毒是因为病毒的蛋白质受热变性
D.淀粉在人体内水解的最终产物为葡萄糖难度: 中等查看答案及解析
-
下列实验设计和结论相符的是( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液难度: 中等查看答案及解析
-
能正确表示下列化学反应的离子方程式是( )
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.金属铝置于浓硝酸中:2Al+6H+=2A13++3H2↑
C.氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3
D.碳酸镁溶于硝酸中:MgCO3+2H+=Mg2++H2O+CO2↑难度: 中等查看答案及解析
-
如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( )
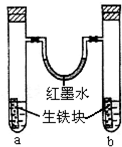
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-→Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀难度: 中等查看答案及解析