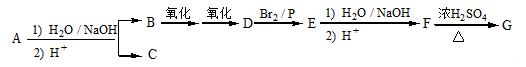-
下列说法中正确的是
A.中子数为18的氯原子可表示为18Cl
B.某金属阳离子的结构示意图为
,其与Cl-形成的化合物都是离子化合物
C.二硫化碳的电子式为
D.17.4g熔融K2SO4与7.8 g熔融Na2O2中阴离子数目相同
难度: 中等查看答案及解析
-
下列装置能达到实验目的的是
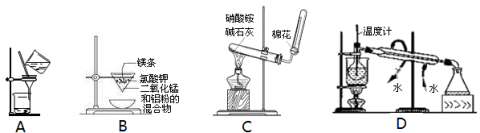
A.除去乙醇中的苯酚 B.制取金属锰
C.实验室制氨气 D.从碘的CCl4溶液中分离I2
难度: 中等查看答案及解析
-
下列说法正确的是
A.石油裂解、煤的气化、海水制镁等过程中都包含化学变化
B.通过化学变化可以实现235U与238U的相互转化
C.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
D.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
难度: 中等查看答案及解析
-
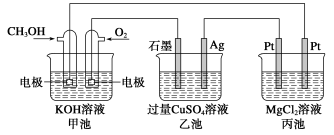
通过NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法不正确的是
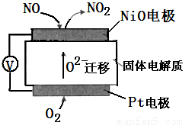
A.Pt电极是该装置的正极
B.正极的电极反应式:O2 + 4e− + 2H2O=4OH−
C.负极的电极反应式:NO−2e−+O2−=NO2
D.固体电解质中O2−向负极移动
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
B.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+OH-+Ca2+===CaCO3↓+H2O
C.C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D.用惰性电极电解MgCl2溶液:2H2O+2Cl-
Cl2↑+H2↑+2OH-
难度: 中等查看答案及解析
-
下列除去杂质的实验方法正确的是
A.除去CO中混有的少量O2:通过灼热的Cu网后收集气体
B.除去SO2中混有的CO2:可通过盛有KMnO4溶液的装置洗气
C.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
D.除去SiO2中的Fe2O3:可加入NaOH溶液后过滤
难度: 简单查看答案及解析
-
下列说法正确的是
A.将标准状况下的2.24L CO2通入150mL 1mol·L-1 NaOH溶液中,所得溶液中c(CO32-) >c(HCO3-)
B.常温下0.1 mol·L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
C.0.1 mol·L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
D.室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c (H+) + c(HA)
难度: 简单查看答案及解析
-
下列说法正确的是
A.室温某酸溶液的pH等于3,则由水电离产生的c(H+)=1×10-11mol/L
B.对于反应X+3Y2
Z,增大压强使平衡向生成Z的方向移动,平衡常数增大
C.自发反应一定是熵增大,非自发反应一定是熵减小或不变
D.某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大
难度: 简单查看答案及解析
-
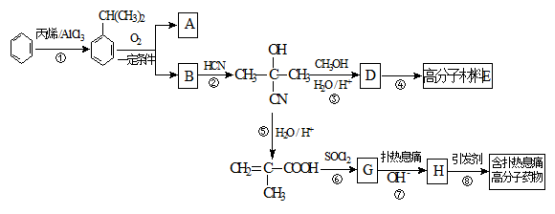
某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
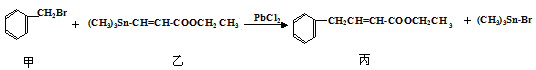
下列分析判断正确的是
A.分离提纯有机物丙宜在NaOH热溶液中进行
B.PbCl2的作用是提高反应物的活性,加快反应速率
C.可用酸性KMnO4溶液检验有机物丙中是否含有机物乙
D.利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素
难度: 中等查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子
B.CO32-、Al3+一定不存在,K+可能存在
C.SO42-、NH4+一定存在,Cl-可能不存在
D.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
难度: 简单查看答案及解析
-
一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)
2SCl2(鲜红色液体) ΔH=-61.16 kJ·mol-1。下列说法正确的是
A.增大压强,平衡常数将增大
B.达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2
C.达到平衡时,若升高温度,氯气的百分含量减小
D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
难度: 简单查看答案及解析
-
现有常温下的四份溶液: ① 0.01 mol/L CH3COOH ② 0.01 mol/LHCl ③pH=12的氨水 ④ pH=12的NaOH溶液,下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将四份溶液稀释相同倍数后,溶液的pH:②﹥①,③﹥④
C.将②③混合,若pH=7,则消耗溶液的体积:②﹥③
D.将①、④混合,若有c(CH3COO-)﹥c(H+),则混合液一定呈碱性
难度: 简单查看答案及解析
-
下列有关实验现象或结论的描述不正确的
A.铅蓄电池充电时,阳极的反应为:PbSO4+2H2O+2e-=PbO2+SO42-+4H+
B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+
C.常温下将5mL0.1mol/LNa2S2O3溶液、5mL0.01mol/LNa2S2O3溶液分别与5mL0.1mol/LH2SO4溶液混合并搅拌,通过记录溶液中出现浑浊的时间,可确定浓度对化学反应速率的影响
D.处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀
难度: 简单查看答案及解析
-
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右图所示,下列说法中不正确的是
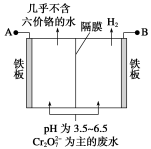
A.A为电源正极
B.阴极区附近溶液pH降低
C.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是

A.①②③ B.②③④ C.①②④ D.③④
难度: 简单查看答案及解析
-
下列关于甲、乙、丙、丁四个图像的说法中,正确的是
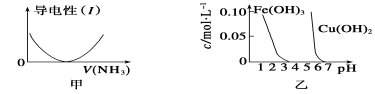

A.图甲表示向盐酸溶液中通入NH3过程中溶液导电性的变化
B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
C.图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
难度: 简单查看答案及解析