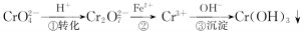-
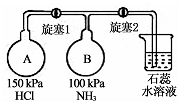
化学与生产、生活、社会密切相关,下列说法错误的是
A.高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一
B.大力发展新型电动汽车,可以减少燃油汽车的尾气排放量
C.生活中常用的蚕丝、棉花、淀粉、油脂等都是由高分子组成的物质
D.塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地且难以降解
难度: 简单查看答案及解析
-
如图A~D四种物质均含有同一种元素,A可以是单质也可以是气态氢化物,D是该元素最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是
A.氯 B.铁 C.碳 D.氮
难度: 中等查看答案及解析
-
下列除杂试剂或方法有错误的是
原物质
所含杂质
除杂试剂
主要操作方法
A
HNO3溶液
H2SO4
BaCl2溶液
过滤
B
CO2
SO2
酸性KMnO4溶液、浓硫酸
洗气、干燥
C
SiO2
Al2O3
稀盐酸
过滤
D
C2H5OH
CH3COOH
CaO
蒸馏
难度: 中等查看答案及解析
-
根据下列三个反应判断有关物质(或微粒)还原性由强到弱的顺序是
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO十+2H2O+Fe(NO3)3
A.H2SO3 >I-> Fe2+ >NO B.I->Fe2+> H2SO3 >NO
C. Fe2+ >I-> H2SO3 >NO D.NO>Fe2+>H2SO3 >I-
难度: 中等查看答案及解析
-
在溶液中加入足量Na2O2后仍能大量共存的离子组是
A. NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、C1-、SO42-
C. Ca2+、Mg2+、NO3-、HCO3- D.Na+、C1-、SO32-、SO42-
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数。下列说法中错误的是
A.标准状况下,22.4L由H2和O2组成的混合气体,所含分子总数为NA
B.1molCl2参加反应,转移的电子数一定为2NA
C.常温常压下,1mol氖气含有的原子数为NA
D.1L1mol/LFeCl3溶液中Fe3+的数目小于NA
难度: 简单查看答案及解析
-
某氯化镁溶液的密度为1.2 g/cm3,其中镁离子的质量分数为4. 0%,500 mL该溶液中Cl-的物质的量等于(不考虑镁离子的水解)
A.0.5 mol B.1.0 mol C.2.0 mol D.4.0 mol
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的简单气态氢化物的热稳定性比W的强
难度: 简单查看答案及解析
-
除虫菊酯是一种从植物除虫菊中提取出来的广谱杀虫剂,结构如图所示,下列描述正确的是
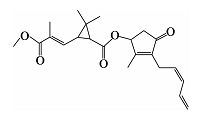
A.除虫菊酯属于芳香族化合物
B.除虫菊酯的分子式为C22H28O5
C.除虫菊酯在镍作催化剂下最多可与7 mol H2发生加成反应,与3 mol NaOH发生水解反应
D.除虫菊酯在酸性条件下发生水解后得到的产物均带有羧基
难度: 简单查看答案及解析
-
已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) △H=+468.2 kJ. mol-l;
C(s) +O2 (g)=CO2 (g) △H=-393.5 kJ. mol-1;则4Fe(s)+3O2(g)=2Fe2O3(s)的△H是
A. -1648.7 kJ.mo1-1 B.-1255.3 kJ. mol-1
C.-861.7 kJ. mol-l D. +867.1 kJ. mol-1
难度: 简单查看答案及解析
-
可逆反应X(g)+Y(g)
2Z(g) △H<0达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
金属镍有广泛的用途。粗镍中含有少量Fe、Cu、Pt等杂质,可用电解法制备高纯度的镍(用NiSO4作电解质溶液)。已知:氧化性Fe2+<Ni2+<Cu2+,下列叙述正确的是
A.阳极发生还原反应,其电极反应式:Ni2+2e=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+
D.电解后,可以从电解槽底部的阳极泥中回收Cu和Pt
难度: 简单查看答案及解析
-
常温下,向20 mL某浓度的盐酸中逐滴加入0.1 mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示。
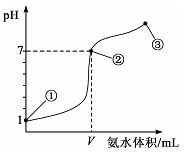
下列叙述正确的是
A.盐酸的物质的量浓度为l mol/L
B.在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
C.在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20
D.在点③所示溶液中:由水电离出的c(OH-)>l0-7mol/L
难度: 中等查看答案及解析
-
铜和镁的合金4.6 g完全溶于一定量的浓硝酸,若反应中硝酸被还原只产生1792 mL的NO2气体和1120 mL的NO气体(都已折算到标准状况),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀的质量为
A.7.04 g B.8.26 g C.8.51 g D.9.02 g
难度: 困难查看答案及解析