-
铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝“确定为食品污染之一”而加以控制。铝在下列场合需加以控制的是( )
①制铝合金;
②制电线制;
③制炊具;
④明矾净水;
⑤明矾和苏打作食物膨化剂;
⑥用氢氧化铝制胃舒平药片;
⑦银色漆颜料;
⑧易拉罐;
⑨用铝箔包装糖果和小食品.
A.③⑤⑧⑨ B.⑥⑧⑨ C.③⑤⑨ D.③④⑤⑥⑧⑨
难度: 中等查看答案及解析
-
下列物质不能通过化合反应得到的是( )
A.Fe (OH)2 B.Fe (OH)3 C.Fe3O4 D.FeS
难度: 中等查看答案及解析
-
向FeC13和BaCl2的酸性混合溶液中.通入SO2气体,有白色沉淀生成。此沉淀是()
A.BaSO4 B.FeS
C.BaSO3 D.S
难度: 中等查看答案及解析
-
下列各组物质中,将前者加入后者时,无论前者是否过量,都能用一个化学方程式表示的是( )
A.稀盐酸,Na2CO3 B.稀硫酸,NaAlO2溶液
C.Cu,FeCl3溶液 D.浓氨水,AgNO3溶液
难度: 中等查看答案及解析
-
在理论上我们可以用电解熔融KCl的方法来制备金属钾,而实际我们不用此法制备钾,而用熔融状态下的KCl与Na反应并及时抽走钾蒸气的方法制备钾,可能的原因是:
①钾的沸点比钠低;
②钾蒸气易逸出而污染环境;
③钾被氧化后的产物与钾反应具有爆炸性;
④抽走钾蒸气时有利于钠与熔化的KCl反应,
其中正确的是( )
A.全部 B.①③ C.①④ D.②④
难度: 简单查看答案及解析
-
某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,且c(H+)=0.1mol•L-1,则在该溶液中可以大量存在的阴离子是( )
A.SO42- B.NO3- C.SCN- D.CO32-
难度: 中等查看答案及解析
-
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知:
(1)a、c均能与稀硫酸反应放出气体
(2)b与d的硝酸盐反应,置换出单质d
(3)c与强碱反应放出气体
(4)c、e在冷浓硫酸中发生钝化.
由此判断a、b、c、d、e依次为( )
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
难度: 中等查看答案及解析
-
有关碳酸氢钠和碳酸钠的性质,以下叙述错误的是( )
A.等质量的Na2CO3、NaHCO3与足量的盐酸反应,在相同条件下Na2CO3产生CO2的体积大
B.等物质的量的Na2CO3和NaHCO3与同浓度的足量盐酸反应,Na2CO3所消耗盐酸的体积是NaHCO3的两倍
C.将石灰水加入Na2CO3和NaHCO3溶液中,都产生白色沉淀
D.同物质的量浓度的两种溶液,碳酸钠溶液的pH大于碳酸氢钠溶液
难度: 中等查看答案及解析
-
制印刷电路时常用氯化铁溶液作为腐蚀液,发生的反应是:2Fe3++Cu=2Fe2++Cu2+.现向盛有溶液的烧杯中同时加入铁粉和铜粉,反应结束时,下列结果不可能出现的是( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
难度: 中等查看答案及解析
-
下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5O-、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-=Fe2+ +I2
C.1L 0.1 mol/L该溶液和足量的Zn充分反应,生成11.2 gFe
D.和过量Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.将澄清石灰水加入过量NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3+CO32-+2H2O
B.将磁性氧化铁溶于盐酸: Fe3O4+8H+═3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO
D.将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
难度: 中等查看答案及解析
-
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
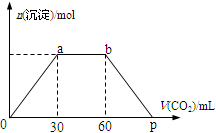
A.原混合物中n[Ba(OH)2]:n[NaOH]=1:2
B.横坐标轴上p点的值为90
C.b点时溶质为NaHCO3
D.ab段发生反应的离子方程式依次为:CO2+2OH-→H2O+CO32-,CO2+H2O+CO32-→2HCO3-
难度: 困难查看答案及解析
-
下列物质的转化在给定条件下能实现的是
A.

B.

C.

D.

难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加1.0mol•L-1Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D
向0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液
先有白色沉淀生成,后变成浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
难度: 困难查看答案及解析
-
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1mol•L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
A.
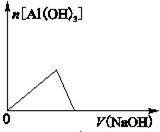 B.
B.C.
D.

难度: 简单查看答案及解析
-
将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.8L(标状),原混合物质量可能是( )
A.2g B. 4g C.10g D.12g
难度: 中等查看答案及解析
-
最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺.这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等.该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气.合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜。下列关于铝、镓的说法正确的是( )
A.铝的金属性比镓强
B.工业上可以用电解熔融氯化铝制备Al
C.Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应
D.铝、镓合金与水反应后的物质可以回收利用冶炼铝
难度: 中等查看答案及解析