-
化学与社会、生活、生产密切相关,下列有关说法中正确的是 ( )
A.明矾能水解产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒
B.菜刀洗净后擦干是为了防止发生化学腐蚀
C.漂白粉溶液可用于夏天游泳池杀菌消毒
D.淀粉溶液和Fe3O4纳米材料都具有丁达尔效应
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A. 从海水中提取多种化学物质都发生了化学变化
B. 可用盛有浓氨水的“喷枪”检验输送氯气的管道是否漏气
C. 铁是人体必需的微量元素,要多食富含Fe3+的食物或服用含Fe3+的药剂
D. 有胃溃疡的病人也可服用小苏打药片治疗胃酸过多
难度: 简单查看答案及解析
-
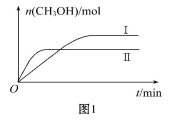
从氯酸钾与二氧化锰制O2后的残余物中提取氯化钾并检验氯化钾中存在钾元素,下列相关实验操作图不正确的是
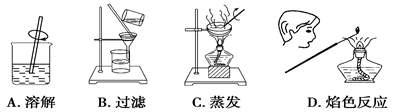
难度: 简单查看答案及解析
-
下列各组中的两种物质相互作用时,在温度、反应物用量、反应物浓度等发生变化时,不会引起产物变化的是 ( )
A.硫与氧气 B.钠与氧气
C.纯碱溶液与稀盐酸 D.铁与HNO3溶液
难度: 简单查看答案及解析
-
下列有关物质分类的说法中正确的是( )
A.金属氧化物均为碱性氧化物
B.非金属氧化物不一定是酸性氧化物
C.溶于水能电离出H+的化合物都是酸
D.由非金属元素组成的化合物一定共价化合物
难度: 简单查看答案及解析
-
某反应的反应过程中的能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列有关叙述中正确的是( )
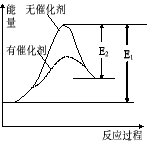
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能改变该反应的正反应的活化能而对逆反应的活化能无影响
D.右图可表示由KClO3 加热制O2反应过程中的能量变化
难度: 简单查看答案及解析
-
下列有关实验的说法中正确的是 ( )
A. “左码右物”称量药品时称量结果一定偏小
B. 用pH试纸无法测出氯水的pH
C. 可用碱式滴定管量取15.65ml 0.10mol/LKMnO4溶液
D. 量取8.2ml浓硫酸时,仰视量筒刻度所得浓硫酸体积偏小
难度: 简单查看答案及解析
-
已知W、X、Y、Z均为中学化学里常见的化学物质,它们之间有如下图所示的转化关系。其中不符合图中转化关系的W、X依次是 ( )
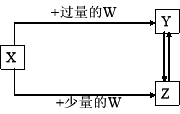
A.W为O2,X为C
B.W为稀HCl,X为NaAlO2溶液
C.W为SO2,X为NaOH溶液
D.W为Cl2,X为Fe
难度: 中等查看答案及解析
-
研究发现空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO,②SO3+H2O→H2SO4,③2NO+O2→2NO2。
NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.浓H2SO4滴入萤石(CaF2)中加热生成HF
C.木材棍插入浓H2SO4中变黑
D.淀粉溶液加入稀H2SO4并加热转化为葡萄糖
难度: 中等查看答案及解析
-
NA表示阿佛加德罗常数的值,下列叙述中正确的是 ( )
A.22.4L标况下的氯气在化学反应中转移的电子数一定为2NA
B.在1L pH=12的K2CO3溶液中由水电离产生的OH-数目为0.01NA
C.14g由N2与C2H4组成的混合气体中含有的氢原子数可能为2NA
D.22.4L标况下的CO2中共用电子对数为2NA
难度: 简单查看答案及解析
-
下列各组离子在指定的溶液中能大量存在离子组的是 ( )
A. pH=7的溶液:Al3+、Fe3+、SO42-、I-
B.加入Na2O2后的溶液:K+、Fe2+、NO3-、SO32-
C.加入铝粉放出H2的溶液:Na+、Ba2+、NO3-、Cl-
D.无色并能使石蕊试液变蓝的溶液:NH4+、Cu2+、NO3-、Cl-
难度: 简单查看答案及解析
-
下列反应的离子方程式中正确的是 ( )
A.将Fe(OH)2投入稀HNO3中:Fe(OH)2+2H+=Fe2++2H2O
B.在Ba(OH)2溶液中滴入少量的KHCO3溶液:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
C.在NaClO溶液中通入少量的SO2:ClO-+SO2+H2O=SO42-+Cl-+2H+
D.在硫酸氢钠溶液中滴加少量纯碱溶液:2H++CO32-=CO2↑+H2O
难度: 简单查看答案及解析
-
实验室常用NaNO2与NH4Cl两种物质的浓溶液混合共热制取少量N2。下列关于该反应的说法中不正确的是 ( )
A.该反应产物除N2外还有NaCl和H2O
B.NaNO2是氧化剂,NH4Cl是还原剂
C.每生成2.24L标况下N2转移0.6mol电子
D.氧化产物和还原产物均为N2
难度: 简单查看答案及解析
-
已知温度T0C时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与
b mol·L-1的一元碱BOH等体积混合,可判定该混合液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
难度: 中等查看答案及解析
-
正确掌握好基本概念和化学用语是学好化学的基础,下列有关表述正确的是 ( )
A.H、D、T互为同素异形体
B.H2O2分子中含有非极性键和极性共价键
C.NH4Cl的电子式为:
D.CO2分子的比例模型图:
难度: 简单查看答案及解析
-
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质M。下列有关分析或说法中正确的是( )
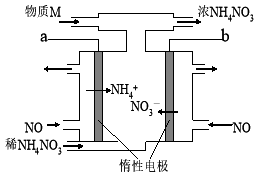
A.a应接直流电源的正极
B.阳极的电极反应式:NO+5e-+6H+=NH4++H2O
C.电路中通过5mol电子时,理论上最可处理22.4L标况下的NO
D.补充的物质M是NH3
难度: 困难查看答案及解析
-
在一密闭容器中反应aA(g)
bB(g)达平衡后,测得c(B)为1mol/L。如保持温度不变,将容器体积变为原来的2倍,重新达到新的平衡时,c(B)变为0.6mol/L,则下列说法不正确的是( )
A.平衡向正反应方向移动 B.物质A的转化率增大
C物质B的质量分数增大 D.a>b
难度: 简单查看答案及解析
-
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测正确的是 ( )
A. 同周期元素中Z的非金属性最强
B. 原子半径X>Y,离子半径X+>Z2-
C. 同周期元素中Y的最高价含氧酸的酸性最强
D. 由X、Y、Z组成的化合物只有一种
难度: 简单查看答案及解析
-
用下表提供的仪器和药品,能完成实验目的的是 ( )
仪器
药品
实验目的
A
烧杯、分液漏斗、
胶头滴管、铁架台待提纯AlCl3溶液、NaOH溶液
除去AlCl3溶液中的
MgCl2杂质B
分液漏斗、烧瓶、
锥形瓶、导管及橡皮塞盐酸、大理石、
硅酸钠溶液证明非金属性:
Cl>C>SiC
酸式滴定管、锥形瓶、
铁架台(带铁夹)已知浓度的盐酸、
待测NaOH溶液测定NaOH溶液的浓度
D
胶头滴管、试管
Na2CO3溶液、稀盐酸
鉴别Na2CO3溶液、稀盐酸
难度: 简单查看答案及解析
-
将0.03 mol Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)( )
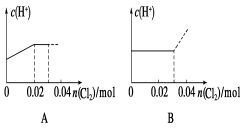
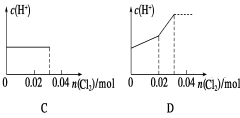
难度: 中等查看答案及解析
-
在25 ℃时,将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶于水中制得1 L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是( )
A.该溶液的pH小于7
B.c(CH3COOH)+c(CH3COO-)=0.20 mol·L-1
C.c(CH3COOH)<c(CH3COO-)
D.c(CH3COO-)+c(OH-)=0.10 mol·L-1
难度: 中等查看答案及解析