-
化学在生活中应用广泛,下列物质性质与对应用途错误的是( )
A. 明矾易水解生成胶体,可用作净水剂 B. 草木灰和硫酸铵混合施用,肥效更高
C. 氮气化学性质稳定,可用作粮食保护气 D. 盛放烧碱溶液的试剂瓶不能用玻璃塞
难度: 简单查看答案及解析
-
已知25 ℃、101 kPa条件下:
①4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是( )
A. O3比O2稳定,由O2变O3为吸热反应
B. O2比O3稳定,由O2变O3为放热反应
C. 等质量的O2比O3能量低,由O2变O3为放热反应
D. 等质量的O2比O3能量低,由O2变O3为吸热反应
难度: 中等查看答案及解析
-
下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是( )
A. K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大
B. 比较Ksp与离子积Qc的相对大小,可判断难溶解电解质在给定条件下沉淀能否生成或溶解
C. K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了
D. 弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka·Kh
难度: 中等查看答案及解析
-
下列有关溶液组成的描述合理的是( )
A. 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
B. 酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
C. 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
D. 无色溶液中可能大量存在Al3+、NH4+、Cl-、HS-
难度: 中等查看答案及解析
-
室温下,水的电离达到平衡:H2O
H++OH-。下列叙述正确的是( )
A. 向水中加入少量NH4Cl固体,平衡向正向移动,Kw变大
B. 向水中加入少量NaOH固体,平衡向正向移动,c(OH-)增大
C. 向水中加入少量固体硫酸氢钠,平衡向逆向移动,c(H+)增大
D. 向水中加入少量NaCl固体,平衡向正向移动,c(H+)=c(OH-)
难度: 简单查看答案及解析
-
用标准浓度的NaOH溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定浓度比实际浓度偏高的是( )
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗,②锥形瓶中有少量蒸馏水,实验时没有烘干处理,③取未知浓度盐酸的酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗,④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失,⑤滴定后读数时,俯视读数.
A. ①④ B. ②③ C. ①③ D. ④⑤
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
B. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
C. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
D. 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
难度: 中等查看答案及解析
-
不能证明乙酸是弱酸的实验事实是( )
A. 相同温度下,Zn粉分别与同浓度的CH3COOH溶液、盐酸反应,与醋酸反应生成H2的速率慢
B. 0.1 mol/L CH3COONa溶液的pH大于7
C. CH3COOH溶液与NaCO3反应生成CO2
D. pH 为2的 CH3COOH溶液1mL,加水稀释到10mL时pH大于2小于3
难度: 中等查看答案及解析
-
不能证明乙酸是弱酸的实验事实是( )
A. 相同温度下,Zn粉分别与同浓度的CH3COOH溶液、盐酸反应,与醋酸反应生成H2的速率慢
B. 0.1 mol/L CH3COONa溶液的pH大于7
C. CH3COOH溶液与NaCO3反应生成CO2
D. pH 为2的 CH3COOH溶液1mL,加水稀释到10mL时pH大于2小于3
【答案】C
【解析】A、酸与金属反应时,溶液中氢离子浓度越大,反应速率越快,乙酸和锌反应,速率比同浓度的盐酸慢,说明乙酸中氢离子浓度比盐酸中小,说明乙酸部分电离,故A正确;B、常温下,测得 CH3COONa溶液的pH>7,说明 CH3COONa为强碱弱酸盐,水解呈碱性,可证明 CH3COOH为弱酸,故B正确;C、CH3COOH溶液与NaCO3反应生成CO2,只能说明醋酸强于碳酸,不能说明醋酸是弱酸,故C错误;D、pH 为2的 CH3COOH溶液1mL,加水稀释到10mL时pH大于2小于3,不等于4,说明醋酸部分电离,故D正确;故选C。
【题型】单选题
【结束】
9某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
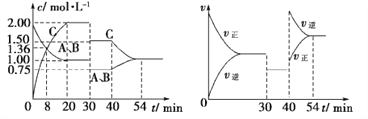
下列说法中正确的是( )
A. 30~40min内该反应使用了催化剂
B. 化学方程式中的x=1,正反应为吸热反应
C. 30min时降低温度,40min时升高温度
D. 8min前A的平均反应速率为0.08mol·L-1·min-1
难度: 中等查看答案及解析
-
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:

下列说法中正确的是( )
A. 30~40min内该反应使用了催化剂
B. 化学方程式中的x=1,正反应为吸热反应
C. 30min时降低温度,40min时升高温度
D. 8min前A的平均反应速率为0.08mol·L-1·min-1
【答案】D
【解析】30分钟时,容器内所有物质的浓度突然成比例减小,所以30分钟时的操作是增大容器体积,选项A错误。因为30分钟时的操作是增大容器体积,相当于减小压强,但是图中看出平衡没有移动,所以两边气体物质的量相等,即x=1。40分钟正逆反应速率都增大,所以改变的条件是增大压强或升高温度,但是增大压强平衡应该不移动,所以是升高温度。升高温度,逆反应速率大于正反应速率,所以平衡向逆反应方向移动,逆反应吸热,正反应放热,选项B错误。30分钟时的操作是增大容器体积,选项C错误。8min前A的平均反应速率为(2-1.36)÷8=0.08 mol·L-1·min-1,选项D正确。
【题型】单选题
【结束】
10某化学研究小组探究外界条件对化学反应mA(g)+nB(g)
pC(g)的速率和平衡的影响图像如下,下列判断正确的是 ( )

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 中等查看答案及解析
-
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)
pC(g)的速率和平衡的影响图像如下,下列判断正确的是 ( )

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
【答案】C
【解析】A. 由图1可知,T2时达到平衡所需时间短,所以T1<T2,升温平衡左移,该反应正反应为放热反应,故A错误;B. 由图2可知,加压平衡右移,说明该反应m+n>p,故B错误;C. 图3中,温度一定,点3达到平衡的过程中B减少,V正>V逆,故C正确;D. 图4中,若m+n=p,加压平衡不移动,则a曲线可能为加压,故D错误。故选C。
点睛:在分析本题图1和图4一类涉及影响反应速率条件的图像时,注意把握图像的关键内容—斜线的斜率,斜率越大,反应速率越大,对应的是有利于增大反应速率的条件。
【题型】单选题
【结束】
11等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)
3Z(g)+Q(s) △H >0,下列叙述正确的是
A. 当容器中X与Y的物质的量的比满足1:2时反应达到平衡
B. 达到平衡时X的转化率为25%,则平衡常数K值为9/4
C. 达到平衡后,反应速率2V正(Y)="3" V逆(Z)
D. 达到平衡后,加入Q,平衡逆向移动
难度: 中等查看答案及解析
-
等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)
3Z(g)+Q(s) △H >0,下列叙述正确的是
A. 当容器中X与Y的物质的量的比满足1:2时反应达到平衡
B. 达到平衡时X的转化率为25%,则平衡常数K值为9/4
C. 达到平衡后,反应速率2V正(Y)="3" V逆(Z)
D. 达到平衡后,加入Q,平衡逆向移动
【答案】B
【解析】试题分析:A.当容器中X与Y的物质的量的比满足1:2时,并不一定是物质的量不变的状态,所以反应不一定达到平衡,A错误;B.设起始时X和Y的物质的量浓度都为1mol/L,则
X(g)+2Y(g)
3Z(g)+Q(s)
初起量(mol) 1 1 0
变化量(mol) 0.25 0.5 0.75
状态1(mol) 0.75 0.5 0.75
Kc=0.753÷(0.75×0.52=9/4,所以平衡常数K值为9/4,B正确;C.达到平衡后,反应速率3V正(Y)="2" V逆(Z),不是2V正(Y)="3" V逆(Z),C错误;D.到平衡后,加入Q,Q是固体,平衡不移动,D错误;答案选B。
考点:考查化学平衡及平衡状态的判断。
【题型】单选题
【结束】
12已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B.
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
难度: 中等查看答案及解析
-
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B.
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
【答案】D
【解析】试题分析:A、CH3COOH属于弱酸,抑制水的电离,加入NH3·H2O,消耗CH3COOH,水的电离程度增大,但氨水过量后,对水电离抑制,故错误;B、当向CH3COOH溶液中滴加相同浓度的NH3·H2O,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh=[c(H+)×c(NH3·H2O)]/c(NH4+),随着氨水的加入,c(H+)逐渐减小,Kh不变,因此c(NH4+)/c(NH3·H2O)变小,当氨水至溶液显碱性时,氨水的电离常数Kb=[c(OH-)×c(NH4+)]/c(NH3·H2O),随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+)/c(NH3·H2O)变小,因此此比值始终变小;C、根据物料守恒,n(CH3COOH)+n(CH3COO-)=0.001mol,由于溶液体积逐渐增大,因此c(CH3COOH)和c(CH3COO-)之和逐渐减小,故错误;D、当加入氨水的体积为10mL,醋酸和NH3·H2O物质的量相等,由于二者电离常数相等,因此溶液显中性,c(H+)=c(OH-),根据电荷守恒,c(NH4+)=c(CH3COO-),故正确。
考点:考查电离平衡常数、水解平衡常数、离子浓度大小比较等知识。
【题型】单选题
【结束】
13常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
难度: 中等查看答案及解析
-
常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
【答案】D
【解析】①(NH4)2Fe(SO4)2溶液中Fe2+的水解对于铵根离子的水解起到抑制作用, ②(NH4)2CO3 中碳酸根离子水解对于铵根离子的水解起到促进作用,③(NH4)2SO4溶液中硫酸根离子对铵根离子的水解无影响,所以溶液中铵根离子的水解程度的大小顺序为:②>③>①。则要达到相同的铵根离子浓度,水解程度大的溶液,物质的浓度应该越大,即溶液浓度由大到小的顺序是:②>③>①。选项A错误。由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,由于醋酸的浓度远大于氢氧化钠的浓度,所以中和以后得到醋酸钠(较少)和醋酸(较多)的混合溶液,溶液显酸性,即c(H+)>c(OH-),根据电荷守恒得到:c(CH3COO-)>c(Na+)。又因为钠离子是醋酸钠完全电离生成的,氢离子使醋酸微弱电离得到的,所以有c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。选项B错误。pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合,两溶液的氢氧根离子和氢离子的浓度刚好相等,等体积混合,恰好中和,溶液显中性。选项C错误。pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,其
,所以
,
,选项D正确。
【题型】单选题
【结束】
14室温下,下列溶液中粒子浓度关系正确的是( )
A. Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4)
B. 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D. pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
难度: 中等查看答案及解析
-
室温下,下列溶液中粒子浓度关系正确的是( )
A. Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4)
B. 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D. pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
【答案】B
【解析】碳酸钠溶液的质子守恒为:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),选项A错误。20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合后得到c(CH3COONa)= c(CH3COOH)= c(NaCl)的混合溶液。溶液显酸性,说明CH3COOH的电离大于CH3COONa的水解,得到:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),选项B正确。CH3COONa的物料守恒为c(Na+)=c(CH3COO-)+c(CH3COOH),CaCl2溶液中一定有2c(Ca2+)= 2c(Cl-),两个等式相加得到:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),选项C错误。溶液有电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+ c(H+),即c(Cl-)=c(NH4+)+ c(H+)- c(OH-),将其带入题目给的式子得到:c(NH4+)+ c(H+)- c(OH-)+c(H+)>c(NH4+)+c(OH-),化简得到c(H+)>c(OH-),即如果题目的结论是对的,则溶液一定显酸性。题目是pH=2的盐酸与pH=12的氨水等体积混合,因为氨水的浓度远大于盐酸,最后一定是氨水完全过量,溶液显碱性,选项D错误。
点睛:酸碱溶液pH之和为14,两个溶液等体积混合,混合后溶液的酸碱性可以按照以下的结论进行判断:谁弱谁过量,谁过量显谁性。此外类似选项D的问题,有一种解决的方法是:先写出一个该溶液的等式(一般为电荷守恒),将其与题目的式子联立化简,得到新的式子,判断该式子是否正确,若该式子正确,则题目式子正确,反之不正确。
【题型】单选题
【结束】
15在恒温条件下,欲使CH3COONa的稀溶液中c(CH3COO-)/c(Na+)比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸
A. 只有②⑤ B. 只有①②⑤
C. 只有①② D. 只有②④⑤
难度: 中等查看答案及解析
-
在恒温条件下,欲使CH3COONa的稀溶液中c(CH3COO-)/c(Na+)比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸
A. 只有②⑤ B. 只有①②⑤
C. 只有①② D. 只有②④⑤
【答案】D
【解析】加入固体NaOH,溶液中c(Na+)明显增大,虽然氢氧根离子会抑制醋酸根离子的水解,但是c(CH3COO-)的增大一定不明显,所以c(CH3COO-)/c(Na+)比值减小,①错误。加入固体KOH,氢氧根离子会抑制CH3COONa的水解,c(CH3COO-)增大,c(CH3COO-)/c(Na+)比值增大,②正确。加入固体NaHSO4,溶液中c(Na+)明显增大,同时电离出的氢离子会促进CH3COONa的水解,c(CH3COO-)减小,c(CH3COO-)/c(Na+)比值减小,③错误。加入固体CH3COONa,增大了溶液中的CH3COONa浓度,浓度越大CH3COONa的水解成都越小,所以c(CH3COO-)/c(Na+)比值越大,④正确。加入冰醋酸,醋酸电离会增大c(CH3COO-),c(CH3COO-)/c(Na+)比值增大,⑤正确。所以正确的是②④⑤,选项D正确。
【题型】单选题
【结束】
1640℃时,在氨—水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
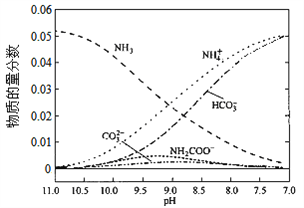
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C. 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
D. 随着CO2的通入,
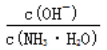 不断增大
不断增大难度: 困难查看答案及解析

 不断增大
不断增大




 ,随着加水稀释,醋酸根的浓度逐渐减小,所以
,随着加水稀释,醋酸根的浓度逐渐减小,所以 ,所以c(H+)=1×10-6mol/L,即pH=6。
,所以c(H+)=1×10-6mol/L,即pH=6。
