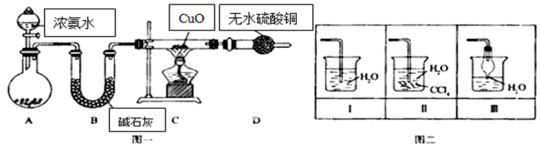
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25 NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.生石灰作干燥剂
C.氢氟酸刻蚀玻璃 D.液氨用作制冷剂
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的叙述错误的是
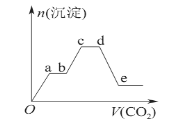
A.Oa段反应的化学方程式是Ba(OH)2+CO2 =BaCO3↓+H2O
B.bc段与cd段所消耗CO2的体积相同
C.bc段反应的离子方程式是2AlO2-+3H2O+CO2 = 2Al(OH)3↓+CO32-
D.de段沉淀减少是由于BaCO3固体的消失
难度: 困难查看答案及解析
-
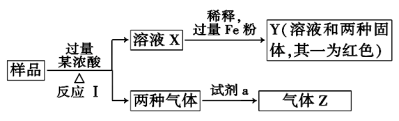
某学生设计了如下方法对X盐进行鉴定:

由此分析,下列结论中正确的是
A.X中一定有Fe3+ B.X一定为FeBr2溶液
C.Y为AgI沉淀 D.Z中一定有Fe3+
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=== 4Fe3++6Cl-+Br2
B.磁性氧化铁溶于氢碘酸:Fe3O4+8H+=== 2Fe3++Fe2++4H2O
C.放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2===2I2+2H2O
D.向硝酸铵溶液中滴加NaOH溶液:NH4++OH-=== NH3↑+ H2O
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.10 L 0.l mol∙L-1的Na2CO3溶液中离子总数一定大于3NA
B.标准状况下,22.4 L HF的分子数为NA
C.1 mol Fe在22.4 L的Cl2(标准状况下)中燃烧,转移的电子总数为3NA
D.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,11.2 L水中含有分子的数目为0.5NA
B.1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA
C.100 mL 0.2 mol·L-1的FeCl3溶液中,含Fe3+数为0.02NA
D.常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.同温同压下,相同体积的物质,所含的粒子数必相等
B.任何条件下,等质量的乙烯和一氧化碳所含的分子数必相等
C.1 L一氧化碳气体的质量一定比1 L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数目一定相等
难度: 中等查看答案及解析
-
下列有关化学与生活、生产的叙述错误的是
A.用作“钡餐”的物质主要成分是硫酸钡
B.采用催化设施,将汽车尾气中CO和NO转化为无害气体
C.SO2具有还原性,可用于漂白纸浆
D.常温下,可以用铁制容器来盛装冷的浓硫酸
难度: 简单查看答案及解析
-
某合作学习小组讨论辨析:
①漂白粉和酸雨都是混合物
②煤和石油都是可再生能源
③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
④不锈钢和目前流通的硬币都是合金
⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑥豆浆和雾都是胶体。
上述说法正确的是
A.①②④⑤ B.①③④⑥ C.①⑤⑥ D.②③④⑤
难度: 简单查看答案及解析
-
下列实验设计能完成或实验结论合理的是
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化
B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.用浓硫酸吸收二氧化硫中混有少量SO3气体
难度: 中等查看答案及解析
-
在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有C12存在
B.加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有C1– 存在
C.溶液呈黄绿色,且有刺激性气味,说明有C12分子存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在
难度: 中等查看答案及解析
-
下列实验现象预测正确的是

A.实验Ⅰ:振荡后静止,上层溶液颜色保持不变
B.实验Ⅱ:酸性KMnO4溶液中出现气泡,但颜色无变化
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:煮沸溶液至红褐色,停止加热,光束通过体系时产生丁达尔效应
难度: 中等查看答案及解析
-
下列实验操作过程中,最后没有沉淀且溶液呈无色透明的是
A.NO2不断通入FeSO4溶液中
B.CO2不断通入CaCl2溶液中
C.NH3不断通入AlCl3溶液中
D.SO2通入已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
下列说法错误的是
A.硝酸能溶解除金、铂外的大多数金属
B.汽车尾气中含有NO和CO
C.浓氨水可检验氯气管道漏气
D.制取二氧化氮时,常用水吸收尾气
难度: 中等查看答案及解析
-
下列关于钠的说法中不正确的是
A.金属钠和氧气反应,条件不同,产物则不同
B.钠长期放置在空气中,最终将变成碳酸钠
C.钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中
D.当钠与硫酸铜溶液反应时,有大量红色固体铜出现
难度: 简单查看答案及解析
-
金属及其化合物转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不全部是通过一步反应完成的是
A.Na→NaOH→Na2CO3→NaCl B.Fe→Fe(NO3)3→Fe(OH)3→Fe2O3
C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Al→Al2O3→Al(OH)3→AlCl3
难度: 中等查看答案及解析
-
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是
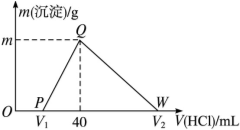
A.原合金质量为0.92 g
B.图中V2为60
C.沉淀的质量m为1.65 g
D.OP段发生的反应为:OH-+H+=== H2O
难度: 困难查看答案及解析
-
Fe2O3、ZnO、CuO的固体混合粉末a g,在加热条件下用足量CO还原,得到金属混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生l0.00g白色沉淀,则a 的数值为
A.4.92 B.6.42 C.7.18 D.14.82
难度: 困难查看答案及解析
-
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
A.冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物
B.HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸
C.漂白粉、福尔马林、冰水、王水、氯水均为混合物
D.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH﹣+O2↑
B.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3﹣=3Fe2++2NO↑+4H2O
C.氯化镁溶液与氨水反应:Mg2++2OH﹣=Mg(OH)2↓
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+AlO2﹣+2H2O
难度: 中等查看答案及解析
-
在相同状况下,一个空瓶,若装满O2称其质量为36 g,若装满CO2称其质量为42 g,若装满A气体,称其质量为52 g,则A的相对分子质量是
A.16 B.32 C.64 D.128
难度: 中等查看答案及解析
-
标准状况下某种O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是
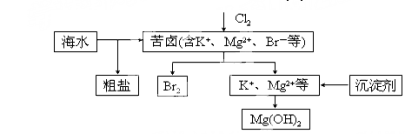
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的Cl2恰好完全反应,则Cl2 的体积在标准状况下为
A.7.84L B.6.72L C.4.48L D.无法计算
难度: 困难查看答案及解析
-
下列物质与其用途完全符合的有
①Na2CO3—制玻璃;②SiO2—太阳能电池;③AgI—人工降雨;
④NaCl—制纯碱;⑤Al2O3—焊接钢轨;⑥NaClO—消毒剂、漂白织物
⑦Fe2O3—红色油漆或涂料⑧MgO—耐火材料
A.4个 B.5个 C.6个 D.7个
难度: 简单查看答案及解析
-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释不正确的是
现象
解释或结论
A
SO2使酸性高锰酸钾溶液退色
SO2表现还原性
B
浓HNO3在光照条件下变黄
浓HNO3不稳定,生成有色产物能溶于浓硝酸
C
某溶液中加入浓NaOH溶液加热,放出气体能使湿润的红色石蕊试纸变蓝
该溶液中一定含有NH4+
D
铝片放入浓硫酸中,无明显变化
说明铝与冷的浓硫酸不发生化学反应
难度: 中等查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
已知
类推
A
将Fe加入CuSO4溶液中
Fe+Cu2+=Cu+Fe2+
将Na加入到CuSO4溶液中
2Na+Cu2+=Cu+2Na+
B
向Ca(ClO)2溶液中通入少量CO2
Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
向Ca(ClO)2溶液中通入少量SO2
Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C
用惰性电极电解NaCl溶液
2Cl-+2H2O
2OH-+H2↑+Cl2↑
用惰性电极电解MgBr2溶液
2Br-+2H2O
2OH-+H2↑+Br2
D
稀盐酸与NaOH溶液反应至中性
H++OH-=H2O
稀HNO3与Ba(OH)2溶液反应至中性
H++OH-=H2O
难度: 困难查看答案及解析
-
下列各组离子在通入SO2前后均能大量共存的是
A.Ba2+、K+、Br-、Cl- B.Na+、Cu2+、OH-、SiO32-
C.NH4+、Al3+、Br-、AlO2- D.Li+、H+、NO3-、SO42-
难度: 中等查看答案及解析
-
下列说法不正确的是
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A.①④ B.①④⑤
C.①②③④ D.①②③④⑤
难度: 中等查看答案及解析