-
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )
A.大量排放NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因
B.采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体
C.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
D.大量燃烧化石燃料排放的废气中含大量SO2 ,从而使雨水的PH=5.6,形成酸雨
难度: 中等查看答案及解析
-
下列溶液分别加热蒸干,可以得到原溶质的是 ( )
A.Fe(NO3)2 B.AlCl3 C.Ca(HCO3)2 D.Na2CO3
难度: 中等查看答案及解析
-
下列有关离子方程式与所述事实相符且正确的是( )
A.铵盐的水【解析】
NH4+ + H2ONH4OH + H+
B.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-==BaSO4↓+H2O
C.用双氧水和稀硫酸处理印刷电路板:Cu + H2O2 + 2H+ = Cu2+ + 2H2O
D.氯气和水的反应:Cl2+H2O == 2H++Cl-+ClO-
难度: 中等查看答案及解析
-
类推的思维方法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否。根据你所掌握的知识,判断下列类推结论中正确的是( )
化 学 事 实
类 推 结 论
A
pH=3的盐酸稀释1000倍后pH=6
pH=6的盐酸稀释1000倍后pH=9
B
用电解熔融MgCl2的方法冶炼金属镁
用电解熔融NaCl的方法冶炼金属钠
C
将SO2通入BaCl2溶液中无沉淀生成
将SO2通入Ba(NO3)2溶液中也无沉淀生成
D
Na在O2中燃烧生成Na2O2
Li在O2中燃烧生成Li2O2
难度: 中等查看答案及解析
-
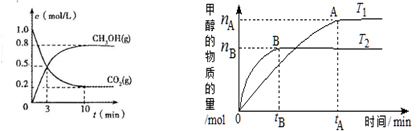
某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g)
Z(g)+W(s) △H>0下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.升高温度,反应速率增大,平衡逆向移动
C.当容器中气体压强不变时,反应达到平衡
D.平衡后加入X,上述反应的△H增大
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.0.l mol·L-l的醋酸加水稀释,c(H+)/c(OH-)减小
B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
D.VlLpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2
难度: 中等查看答案及解析
-
下列叙述中正确的是 ( )
①标准状况下,1g H2和14g N2的体积相同;②标准状况下,1LHCl和1L H2O的物质的量相同;③在同温同体积时,气体物质的物质的量越大,则压强越大;④两种物质的物质的量相同,则它们在标准状况下的体积也相同;⑤28 g CO的体积为22.4 L;⑥常温下,0.2molCl2溶于等体积水中,转移电子数为0.2 NA;⑦同温同压下气体的密度与气体的相对分子质量成正比。
A.①③⑦ B.②⑤⑥ C.②③⑦ D.④⑤⑥
难度: 中等查看答案及解析
-
下列离子或分子组中能大量共存,且满足相应要求的是( )
选项
离 子
要 求
A
K+、A1O2-、Cl-、MnO4-
c(K+)<c(Cl-)
B
Fe3+、NO3-、I-、HCO3-
逐滴滴加盐酸立即有气体产生
C
Na+、Ag+、NO3-、Ba2+
逐滴滴加浓氨水先有沉淀产生,后沉淀消失
D
NH4+、Al3+、SO42-、CH3COOH
滴加NaOH浓溶液立刻有气体产生
难度: 困难查看答案及解析
-
下列有关的叙述正确的是( )
A.已知2H2(g)+O2(g) 2H2O(l);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.C(s,石墨)=C(s,金刚石);△H=+1.9kJ·mol—1,说明金刚石比石墨稳定
C.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,则:该反应任何温度下都能自发进行
D.已知;C(s)+1/2O2(g)=CO(g) △H1 ;C(s)+O2(g)=CO2(g) △H2,则△H1<△H2
难度: 中等查看答案及解析
-
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图。下列说法正确的是( )
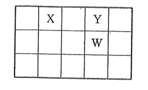
A.五种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.Y的简单阴离子比W的简单阴离子还原性强
D.Z与Q形成的化合物水溶液一定显酸性
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应:
A(s)+3B(g)
2C(g)+D(g) 已达平衡状态的是 ( )
①混合气体的压强;②混合气体的密度;③B的物质的量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量
A.①②③ B.①③⑤ C.①④⑤ D.②③⑤
难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+
B.H2O2+H2SO4 = SO2↑+O2↑+2H2O
C.I2+SO2+2H2O = H2SO4+2HI
D.2Fe2++Cl2 = 2Fe3++2Cl-
难度: 中等查看答案及解析
-
对于可逆反应2AB3(g)
2A(g) + 3B2(g) ΔH>0 下列图象不正确的是( )

难度: 中等查看答案及解析
-
0.02mol·L-1的HCN溶液与0.02mol·L-1NaCN溶液等体积混合,已知混合溶液中:
c(CN-)﹤c(Na+),则下列关系中,正确的是 ( )
A.c(Na+)﹥c(CN-)﹥c(H+)﹥c(OH-) B.c(HCN)+c(CN-)=0.04mol·L-1
C.c(Na+)+c(H+)=c(CN-)+c(OH-) D.c(CN-)﹥c(HCN)
难度: 中等查看答案及解析
-
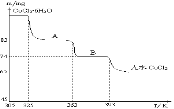
现有MgCl2和Al2(SO4)3混合溶液,向其中不断加入Na2O2,得到沉淀的量与加入Na2O2的物质的量如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
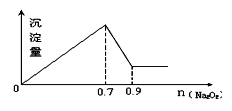
A.1:3 B.2:3
C.6:1 D.3:1
难度: 中等查看答案及解析
-
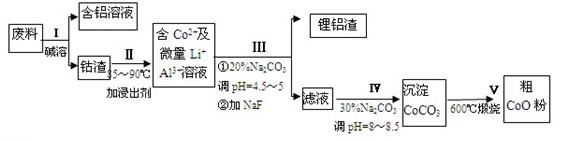
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是 ( )
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 中等查看答案及解析