-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:

(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。
H++A2-。
(1)常温下NaHA溶液的pH________(填序号,下同),原因是_____________。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
-
弱电解质的电离平衡、盐类的水解平衡和难溶电解质的溶解平衡均属于化学学习中的动态平衡。已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
(1)Na2A溶液显碱性的原因 (用离子方程式回答);
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 。
A.c(H+)·c(OH-)=1×10―14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) △H>0。 Ksp=C(Ca2+)·C(A2—)
Ca2+(aq)+A2-(aq) △H>0。 Ksp=C(Ca2+)·C(A2—)
①降低温度时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,C(Ca2+) ,原因是 ;
(4)CaCO3是一种难溶物质,其Ksp=2.8×10—9,CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1. 77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为______________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是_____________,溶液中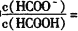 ___________。
___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
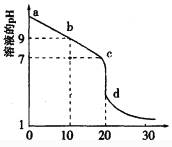
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中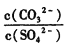 =___________(保留三位有效数字)。
=___________(保留三位有效数字)。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题:
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数 (25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)____________。
③向NaCN溶液通入少量CO2反应的化学方程式是_________________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是__________________________________________________;此时c(HCN)/c(CN-)=________。
②HCN溶液有挥发性,HCN是有剧毒的物质,实验室在做有关NaCN的实验时尽量不采用的实验条件是__________________。
A、冰水浴 B、加热 C、浓溶液 D、稀溶液 E、酸性条件 F、碱性条件
③常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是__________________________________。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
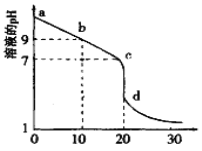
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。
-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:下表是不同温度下水的离子积数据:
| 温度 / ℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”)。
(2)25℃时,某HCl溶液中c(HCl)=1×10-4 mol·L-1,则该溶液的pH=________,此时c(H+)H2O=________mol/L。加水稀释1000倍,则稀释后溶液中pH____ _7(填“>”“<”或“=”)。
(3)t2℃时,将pH=11的氢氧化钠钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=____________。
-
下列过程与“盐类的水解平衡”或“难溶电解质的溶解平衡”无关的是
A. 将NaOH溶液加入NaHSO4溶液中使其转化为Na2SO4
B. 将TiCl4加入水中并加热使其转化为TiO2•xH2O
C. 将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3
D. 将Na2S溶液加入含Hg2+的废水中使其转化为HgS沉淀
-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1mol•L-1的(NH4)2SO4溶液,用离子方程式表示该溶液显酸性的原因:___,在该溶液中各种离子浓度由大到小的顺序为___。
(2)B为0.1mol•L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:__(用离子方程式和必要的文字说明)。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入__,目的是___;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子浓度由大到小的顺序为 。
(2)B为0.1 mol·L-1 NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
H++HA-,HA-
H++A2-。
Ca2+(aq)+A2-(aq) △H>0。 Ksp=C(Ca2+)·C(A2—)
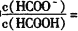 ___________。
___________。
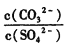 =___________(保留三位有效数字)。
=___________(保留三位有效数字)。