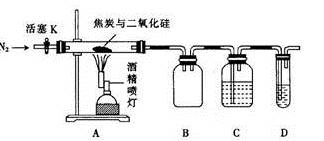
-
化学在生产、生活中有着重要用途,下列物质的用途及对应解释都正确的是
选项
物质
用途
解释
A
Al2O3
耐火材料
Al2O3的熔沸点较高
B
SiO2
计算机芯片
SiO2是一种良好的半导体
C
Fe3O4
红色涂料
Fe3O4是一种红色氧化物
D
浓H2SO4
干燥剂
浓H2SO4有脱水性
难度: 简单查看答案及解析
-
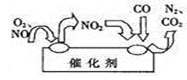
从石墨中分离出来的石墨烯是最薄、最坚硬、几乎透明的物质,可制成电阻率最小的纳米材料,其结构如图所示。下列关于石墨烯的说法不正确的是
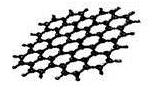
A.具有良好的导电性和透光性
B.石墨烯属于新型有机化合物,熔沸点较高
C.石墨烯、金刚石互为同素异形体
D.在氧气中燃烧可能生成CO2、CO或二者的混合物
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下均能通过一步反应实现的是
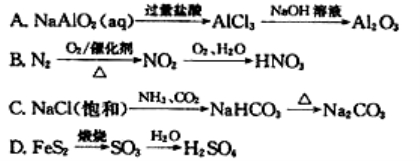
难度: 中等查看答案及解析
-
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是
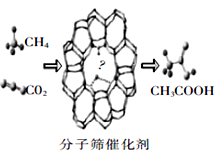
A.消耗22.4 L CO2可制得1mol乙酸
B.该反应属于取代反应
C.反应物和生成物中均含有极性键和非极性键
D.该反应过程符合“绿色化学”原理,其原子利用率为100%
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列说法正确的是
A.标准状况下,22.4 L由NO2和NO组成的混合气体中含有的氧原子数目为2NA
B.常温常压下,含34 g H2O2的溶液中氢原子的物质的量为2mol
C.高温下,16.8 g Fe与足量水蒸气完全反应,失去0.8NA个电子
D.常温下,100 mL l mol·L-l盐酸与4.6 g钠反应生成0.05 mol H2
难度: 中等查看答案及解析
-
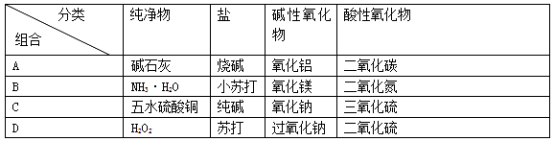
下列物质分类正确的是
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.电解氯化镁溶液: 2Cl- + 2H2O===== Cl2 ↑+ H2↑+ 2OH-
B.向AlCl3溶液中加入过量的氨水: Al3+ + 4NH3·H2O=====AlO2-+ 4NH4++ 2H2O
C.Cu与浓硝酸反应制备NO2: 3Cu + 8H+ + 2NO3-=====3Cu2+ + 2NO2↑ + 4H2O
D.向KAl(S04)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3+ + 2SO42- + 2Ba2+ + 4OH-=====AlO2-+ 2BaSO4 ↓+ 2H2O
难度: 困难查看答案及解析
-
二氧化硒( SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。在回收过程中涉及如下化学反应:①SeO2 + 4KI + 4HNO3 =Se + 2I2 + 4KNO3 + 2H2O;②Se + 2H2SO4(浓) = 2SO2↑+ SeO2 + 2H2O;③Se + 4HNO3(浓) = SeO2 + 4NO2↑+ 2H2O。下列有关叙述正确的是
A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
B.反应①中Se是氧化产物,I2是还原产物
C.反应①中生成0.6 mol I2,转移的电子数目为2.4NA
D.反应②、③中等量的Se消耗浓H2SO4和浓HNO3的物质的量之比为2:1
难度: 困难查看答案及解析
-
向由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物中加入足量的盐酸,有气体放出,将生成的气体通过足量的NaOH溶液,气体体积减少一部分;将上述混合物在空气中加热,有气体放出。下列判断正确的是
A.混合物中一定不含Na2CO3、NaCl
B.混合物中一定含有Na2O2、NaHCO3
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O2、NaCl
难度: 困难查看答案及解析
-
下列根据实验操作和实验现象所得出的结论不正确的是
选项
实验操作
实验现象
结论
A
将饱和FeCl3溶液加入沸水,加热至液体呈红褐色,用激光笔照射
有丁达尔效应
红褐色液体为胶体
B
向溶液X中加入NaHCO3粉末
产生无色气体
X一定属于酸
C
淀粉NaI溶液中加入氯水
溶液变蓝
氧化性:Cl2>I2
D
将气体X分别通入溴水和酸性高锰酸钾溶液
两溶液均褪色
X可能是SO2
难度: 中等查看答案及解析
-
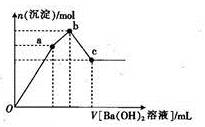
向一定量的盐酸中逐滴加入NaAlO2溶液,生成沉淀Al(OH)3的量随NaAlO2加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
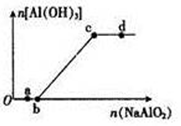
A.a点对应的溶液中: Na+、Fe3+、SO42-、HCO3-
B.b点对应的溶液中: Ag+、Ca2+、NO3-、H+
C.c点对应的溶液中: Na+、K+、SO42-、Cl-
D.d点对应的溶液中: K+、NH4+、I-、H+
难度: 中等查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
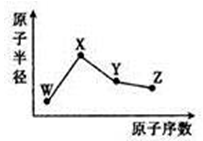
A.简单离子半径:W>X>Z
B.最简单气态氢化物的稳定性:Y<Z
C.化合物XZW中既含离子键又含共价键
D.Y的氧化物能与X的最高价氧化物对应的水化物反应
难度: 中等查看答案及解析
-
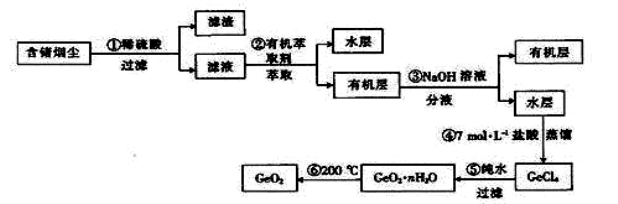
为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程。
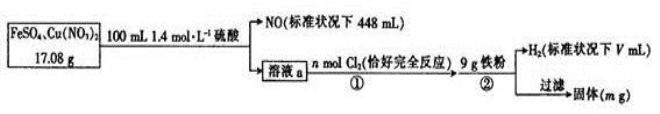 下列叙述中错误的是
下列叙述中错误的是A.n = 0.02
B.V = 2240
C.原混合物中FeSO4的质量分数约为89%
D.m = 3.2
难度: 困难查看答案及解析