-
下列各组大小关系比较中错误的是( )
A. 热稳定性:NaHCO3>Na2CO3 B. 酸性:H2CO3>HClO
C. 氧化性:稀硝酸>稀硫酸 D. 结合OH- 的能力: Fe3+>NH4+
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 电解 NaCl 溶液、 熔融态的氯化镁可制得相应的金属单质
B. 工业上可用含 Cu2S 的矿石和氧化剂 O2 反应冶炼 Cu
C. 铝热反应可用于冶炼高熔点金属,如 K、 Ca、 Cr、 Mn 等
D. 工业电解熔融态的 Al2O3 制 Al 时,加冰晶石的主要作用是提高 Al 的产量
难度: 中等查看答案及解析
-
下列危险化学品标志中表示腐蚀品的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
假设 x 是ⅡB族中元素的原子序数, 那么原子序数为 x+1 的元素在( )
A. ⅢB 族 B. Ⅰ B 族 C. ⅢA 族 D. Ⅱ A 族
难度: 中等查看答案及解析
-
下列分子中,其中子总数为 24 的是( )
A. 18O2 B. D217O2 C. 14N16O2 D. 14C16O2
难度: 中等查看答案及解析
-
下列有关电子式的书写正确的是( )
A. N2 的电子式:
B. NH4Cl 的电子式:
C. HClO 的电子式:
D. CO2 的电子式:
难度: 中等查看答案及解析
-
下列实验中,不能观察到明显变化的是( )
A. 把绿豆大的钾投入水中
B. 把 Cl2 通入 FeCl2 和 KSCN 的混合溶液中
C. 把一段打磨过的镁带放入少量冷水中
D. 把溴水滴入 KI 淀粉溶液中
难度: 中等查看答案及解析
-
下列实验操作中不正确的是( )
A. 容量瓶在使用之前,需要对其检漏
B. 蒸馏完毕时,先停止加热,再关闭冷凝水
C. 萃取操作时,可以选用 CCl4 或酒精萃取碘水中的碘
D. 分液时,下层溶液先从下口放出,上层溶液再从上口倒出
难度: 中等查看答案及解析
-
下列有关硅及其化合物的说法错误的是( )
A. 硅酸钠的水溶液俗称水玻璃,可作木材防火剂
B. 高纯度的二氧化硅广泛用于制作光导纤维, 光导纤维遇强碱会“断路”
C. 硅元素在自然界中以游离态和化合态存在,水晶和干冰均为分子构成的晶体
D. 氢氟酸能和玻璃发生化学反应,所以氢氟酸要存放在塑料瓶中
难度: 中等查看答案及解析
-
下列化合物中的所有原子周围都满足 8 电子稳定结构的是( )
A. CCl4 B. H2O2 C. PCl5 D. LiF
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 离子键就是阴阳离子间的静电引力
B. 氢键比范德华力强, 是一种较弱的化学键
C. 不是所有物质中均存在化学键
D. 含有共价键的化合物一定是共价化合物
难度: 中等查看答案及解析
-
对于可能存在的第119号元素, 有人称之为“类钫”。 根据周期表结构及元素性质变化趋势, 判断下列有关“类钫”的预测说法不正确的是( )
A. “类钫”元素位于元素周期表的第八周期, 在化合物中显+1 价
B. “类钫”元素的非金属性极强, 其最高价氧化物对应的水化物为强酸
C. “类钫”单质遇水剧烈反应, 可能发生爆炸
D. “类钫”单质的密度大于钫单质,且大于 1g/cm3
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. NaHSO4 在熔融状态下电离与在水中电离时,破坏的化学键完全相同
B. H2O 比 H2S 分子稳定,是因为 H2O 分子间能形成氢键
C. NaCl 和 HCl 气化时,克服的作用力不相同, 故沸点不同
D. 碘沸点低、 易升华, 是因为分子中的 I—I 键能较小
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 过量铁分别与浓硫酸、 浓硝酸加热反应均可以得到氢气
B. 硅酸盐 NaAlSiO4·nH2O 可改写成氧化物形式为: Na2O·Al2O3·2SiO2·2nH2O
C. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的 CO2
D. Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属A1、Cu、Fe都小
难度: 中等查看答案及解析
-
下列实验现象预测正确的是( )
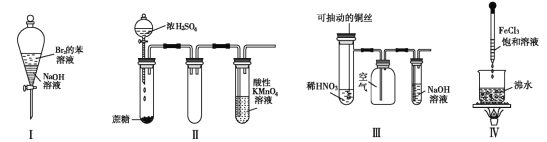
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
难度: 中等查看答案及解析
-
下列反应的离子方程式不正确的是( )
A. 硫化亚铁与浓硫酸混合加热: 2H+ + FeS==H2S↑+ Fe2+
B. 向海带灰浸出液中加入稀硫酸、双氧水: 2I-+ 2H+ + H2O2 =I2 + 2H2O
C. 澄清石灰水中滴加过量 NaHCO3 溶液: Ca2+ + 2OH-+ 2HCO3-=CaCO3↓+ CO32-+ 2H2O
D. 工业上制硝酸过程中,NO2与H2O反应: 3NO2 + H2O=2H++ 2NO3-+NO
难度: 中等查看答案及解析
-
“类比法”是化学学习过程中一种重要方法, 以下类比关系正确的是( )
A. Na 在空气中燃烧会生成 Na2O2,故 Li 在空气中燃烧也会生成 Li2O2
B. 氧化铁和氧化亚铁都是碱性氧化物,和稀盐酸反应都只生成盐和水
C. F、Cl原子最外层均 7个电子, Cl元素的最高正价为+7价, 故F元素最高正价也为+7
D. 卤族元素单质随核电荷数增加熔点升高,故碱金属单质熔点也随核电荷数增加而升高
难度: 中等查看答案及解析
-
设 NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 100g 质量分数为 46%的乙醇(C2H5OH)溶液中含氧原子总数为 4NA
B. 标准状况下, 2.24 L CCl4 含有的共价键数为 0.4NA
C. 1 L 0.1 mol·L-1 的乙酸(CH3COOH)溶液中含 H+的数量为 0.1NA
D. 235g核素23592U发生裂变反应:
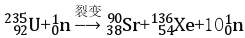 ,净产生的中子(
,净产生的中子()数为10NA
难度: 困难查看答案及解析
-
根据 SO2 通入不同溶液中的实验现象,所得结论正确的是( )
实验
现象
结论
A
酸性 KMnO4 溶液
紫色溶液褪色
说明SO2有漂白性
B
H2S 溶液
产生黄色沉淀
黄色沉淀为S,说明SO2有氧化性
C
Na2SiO3 溶液
产生胶状沉淀
酸性: H2SO3>H2SiO3
非金属性: S>Si
D
含 HCl、 BaCl2 的 FeCl3 溶液
产生白色沉淀
白色沉淀为 BaSO3,说明 SO2 有还原性
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;两成键元素间电负性差值大于 1.7 时,形成离子键,两成键元素间电负性差值小于 1.7 时,形成共价键。下表给出了14 种元素的电负性,则下列说法错误的是( )
元素
Al
B
Be
C
Cl
F
Li
Mg
N
Na
O
P
S
Si
电负性
1.5
2.0
1.5
2.5
2.8
4.0
1.0
1.2
3.0
0.9
3.5
2.1
2.5
1.7
A. 随着原子序数递增,元素的电负性呈周期性变化
B. 元素电负性越大,其非金属性越强
C. 根据电负性数据可知 Mg3N2 中含有离子键
D. BeCl2 因含金属元素铍,故属于离子化合物
难度: 中等查看答案及解析
-
a、b、c 均是短周期元素,a、b处于同一周期,a、c 的最低价离子分别为a2-和c-,b+和c-离子具有相同的电子层结构。下列说法正确的是( )
A. 单质沸点: a>b>c B. 原子最外层电子数: a>b>c
C. 原子序数: a>b>c D. 离子半径: a2->b+>c-
难度: 困难查看答案及解析


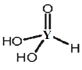 。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式______。(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式______。(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)