-
下列有关描述中不正确的是( )
A.在所有氧化还原反应中,氧化剂的氧化性一定强于氧化产物的氧化性
B.反应A(g)+3B(g)⇌2C(g)达平衡后,温度不变,增大压强,平衡正向移动但平衡常数K不变
C.在KI溶液中加入氯化银固体,一段时间后沉淀变成黄色,说明同温度下KSP(AgI)<KSP(AgCl)
D.常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0难度: 中等查看答案及解析
-
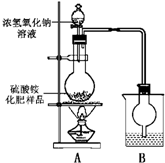
下图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y型管和止水夹分别接c、d两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙分别盛放的溶液是( )
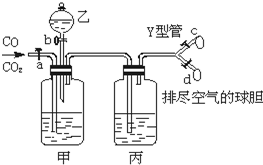
A.NaHCO3饱和溶液 12 mol•L-1盐酸 18.4 mol•L-1H2SO4
B.Na2CO3饱和溶液 2 mol•L-1H2SO4 18.4 mol•L-1H2SO4
C.NaOH饱和溶液 2 mol•L-1H2SO4 18.4 mol•L-1H2SO4
D.18.4 mol•L-1H2SO4 NaOH饱和溶液 18.4 mol•L-1H2SO4难度: 中等查看答案及解析
-
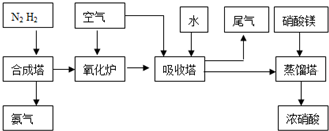
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点.其中一种镁原电池的反应为:xMg+Mo3S4
MgxMo3S4;在镁原电池放电时,下列说法错误的是( )
A.Mg2+向正极迁移
B.正极反应为:Mo3S4+2xe-=Mo3S42x-
C.Mo3S4发生氧化反应
D.负极反应为:xMg-2xe-=xMg2+难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列叙述错误的是( )
A.2mol乙醇和1mol乙二酸反应生成乙二酸二乙酯时,生成的水分子数为2NA
B.3.2g N2H4中共用电子对的数目为0.5NA
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.同温下,1L 0.5mol•L-1NH4Cl溶液与2L 0.25mol•L-1NH4Cl溶液含NH4+物质的量不同难度: 中等查看答案及解析
-
下列溶液中,各组离子一定能够大量共存的是( )
A.无色溶液中:K+、H+、SO42-、MnO4-
B.的溶液中:K+、Na+、CO32-、[Al(OH)4]-
C.能使pH试纸变蓝色的溶液中:Ca2+、Na+、CO32-、SO42-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-难度: 中等查看答案及解析
-
某化学兴趣小组设计了下列四个实验装置,试图通过观察实验现象说明CO2与NaOH溶液发生了反应.其中无法达到实验目的是
( )
A.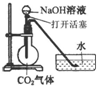
B.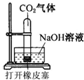
C.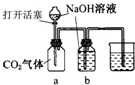
D.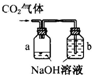
难度: 中等查看答案及解析
-
下列实验能达到预期目的是( )
A.为减小配制溶液的误差,容量瓶必须洗净并烘干后才能使用
B.向溶液中滴入盐酸有无色无味气体产生,则证明溶液中有CO32-
C.含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2,充分反应后过滤可除去Ca(OH)2
D.把纯净的铁和锌用导线连接一起插入到经过酸化的3%的NaCl溶液中,往铁电极区滴入2滴KSCN,有红色出现难度: 中等查看答案及解析
-
已知:H2O(g)═H2O(l)△H1=-Q1kJ•mol-1(Q1>0)
C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ•mol-1(Q2>0)
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ•mol-1(Q3>0)
依据盖斯定律,若使23g液态乙醇完全燃烧并恢复至室温,则放出的热量为(单位:kJ)( )
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.向氯化铝溶液中加入过量氨水:A13++4NH3•H2O═A102-+4NH4++2H2O
B.甲醛与足量银氨溶液共热:HCHO+2[Ag(NH3)2]++2OH--HCOO-+NH4++2Ag↓+3NH3+H2O
C.用石墨电极电解硝酸银溶液:2Ag++2H2O2Ag+O2↑+4H+
D.向碳酸氢钙溶液中滴加过量的烧碱溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-难度: 中等查看答案及解析
-
有A、B、C三种短周期元素,最外层电子数之和为17,质子数之和为31.若C为Ar,则关于A、B两种元素的说法错误的是( )
A.如果A是金属元素,则B一定是稀有元素
B.如果A的单质通常情况下是气体,则B的单质通常情况下是固体
C.如果A的气态氢化物的水溶液显碱性,则B的气态氢化物的水溶液显酸性
D.如果A的最高正价是+3,则B的单质有两种常见的同素异形体难度: 中等查看答案及解析
-
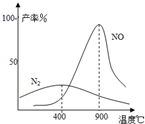
下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)( )
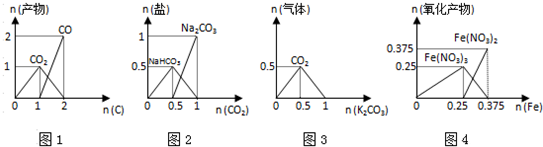
A.图1:n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
B.图2:n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
C.图3:n(HCl)=1mol时,K2CO3逐步加入到HCl溶液中在敞口容器反应生成的气体
D.图4:n(HNO3)=1mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)难度: 中等查看答案及解析
-
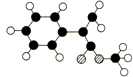
三聚氰胺俗称蜜胺,主要用于生产三聚氰胺一甲醛树脂.三聚氰胺微溶于冷水,易结晶,可溶于热水,低毒.在一般情况下较稳定,但在高温下可能会分解放出氰化物.其结构式如图,下列有关说法不正确的是( )
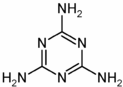
A.用三聚氰胺制造的餐具不可以放进微波炉中加热使用
B.长期摄入三聚氰胺会造成生殖、泌尿系统的损害,使膀胱、肾部结石
C.该化合物属于芳香烃
D.三聚氰胺呈弱碱性,可与盐酸、硫酸等酸反应形成三聚氰胺盐难度: 中等查看答案及解析
-
常温下,现有a mol/L NaX溶液和b mol/L NaY溶液,关于它们的说法错误的是( )
A.若a=b,pH(NaX)>pH(NaY),则相同浓度时HX、HY的酸性:HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY),如果HX是强酸,则HY一定是弱酸
C.若a>b,且上述两溶液呈碱性,c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY)
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a=b=0.1mol/L难度: 中等查看答案及解析
-
某温度下,在一密闭容器中发生如下可逆反应:2E(g)⇌F(g)+xG(g);△H<0.若起始时E浓度为a mol•L-1,F、G浓度均为0,达平衡时E浓度为O.5a mol•L-1;若E的起始浓度改为 2a mol•L-1,F、G浓度仍为O,当达到新的平衡时,下列说法正确的是( )
A.升高温度时,正反应速率加快、逆反应速率减慢
B.若x=l,容器体积保持不变,新平衡下E的体积分数为50%
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度小于0.5a mol•L-1
D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol难度: 中等查看答案及解析