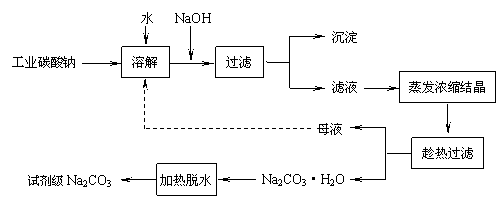
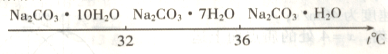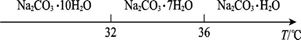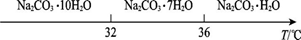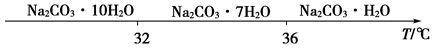-
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
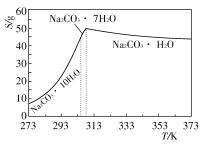
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

Ⅱ、25℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为______.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=______.
(2)“趁热过滤”时的温度应控制在______.
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用.请你分析实际工业生产中是否可行______,并说明理由______.
(4)已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1写出Na2CO3•H2O脱水反应的热化学方程式______.
-
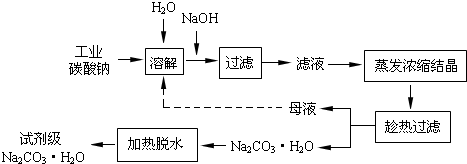
(20分)碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用。
(1)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示
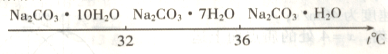
请回答下列问题:
①试剂A是________,“母液”中除了含有Na+、CO32-、OH-离子外,还含有________等离子,过滤要“趁热”的目的是________。
②检验试剂级Na2CO3中Cl-和SO42-是否除尽,选用的试剂及加入的先后次序是________(填序号)。
a.HCl、BaCl2、AgNO3
b.AgNO3、HNO3、Ba(NO3)2
c.HNO3、Ba(NO3)2、AgNO3
d.AgNO3、HCl、BaCl2
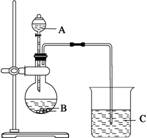
(2)“侯氏制碱法”的原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
下图是某兴趣小组在实验室中模拟“侯氏制碱法”制取所用到的主要装置。
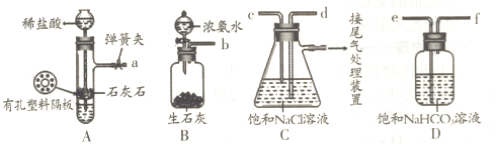
请回答下列问题:
①各仪器口的链接顺序为a接________,________接________,________ 接b,实验时先向饱和NaCl溶液中通入较多的NH3,再通人足量的CO2,其原因是________(填写序号字母)。
a.使CO2更易被吸收
b.NH3比CO2更易制取
c.CO2的密度比NH3大
②将生成的NaHCO3晶体从混合物中分离出来需要的玻璃仪器是________。
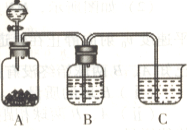
③该兴趣小组用下图比较C、N、Si三种元素的非金属性强弱,B中的试剂是________,能说明碳的非金属性比硅强的实验现象是________(H2SiO3是一种不溶于水的白色胶状物)。
-
(14分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
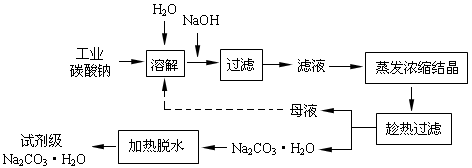
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:

Ⅱ、25℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为:
▲。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c(Mg2+):c(Fe3+)=▲ 。
(2)“趁热过滤”时的温度应控制在▲。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。
请你分析实际工业生产中是否可行▲ ,并说明理由:________
▲。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 532.36kJ·mol-1
Na2CO3·10 H2O (s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式▲ 。
-
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
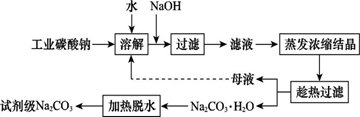
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
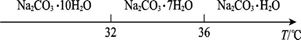
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为________。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=________。
(2)“母液”中除了含有Na+、CO32—外,还含有________等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行:________(填“可行”或“不可行”),并说明理由:________ 。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) =+532.36 kJ·mol-1
=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)  =+473.63 kJ·mol-1
=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:________。
-
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
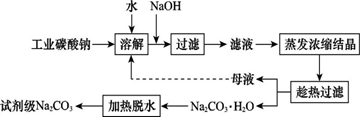
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
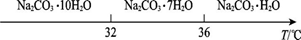
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为________。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=________。
(2)“母液”中除了含有Na+、CO32—外,还含有________等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行:________(填“可行”或“不可行”),并说明理由:________ 。
(4)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g) =+532.36 kJ·mol-1
=+532.36 kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g)  =+473.63 kJ·mol-1
=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:________。
-
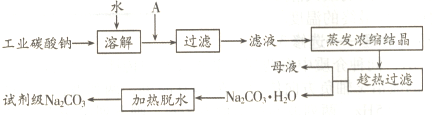
(1)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
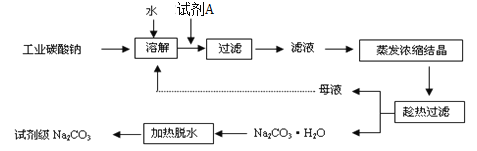
碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

请回答下列问题:
①试剂A是_______,“母液”中除了含有Na+、CO32-、OH-外,还含有_____等离子,过滤要“趁热”的目的是______。
②检验试剂Na2CO3中Cl-和SO42-是否除尽,选用的试剂及加入的先后次序是___________(填字母)。
a.HCl、BaCl2、AgNO3 b.AgNO3 HNO3、Ba(NO3)2 c. HNO3、Ba(NO3)2、AgNO3 d.AgNO3、HCl、BaCl2
(2)“侯氏制碱法”的原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
如图是某兴趣小组在实验室中模拟“侯氏制碱法”制取NaHCO3所用到的主要装置。
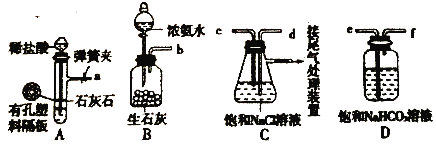
请回答下列问题:
①各仪器口的连接顺序为a接________接b,实验时先向饱和NaCl溶液中通入较多的NH3,再通人足量的CO2,其原因是________(填 写序号字母)。
a.使CO2更易被吸收 b.NH3比CO2更易制取 c.CO2的密度比NH3大
②将生成的NaHCO3晶体从混合物中分离出来需要的玻 璃仪器是________。
-
碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用。
(1)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO 等杂质,提纯工艺线路如下:
等杂质,提纯工艺线路如下:
碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
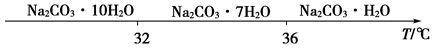
请回答下列问题:
①试剂A是________,“母液”中除了含有Na+、CO 、OH-外,还含有________等离子,过滤要“趁热”的目的是____________________________。
、OH-外,还含有________等离子,过滤要“趁热”的目的是____________________________。
②检验试剂级Na2CO3中Cl-和SO 是否除尽,选用的试剂及加入的先后次序是________(填字母)。
是否除尽,选用的试剂及加入的先后次序是________(填字母)。
a.HCl、BaCl2、AgNO3
b.AgNO3、HNO3、Ba(NO3)2
c.HNO3、Ba(NO3)2、AgNO3
d.AgNO3、HCl、BaCl2
(2)“侯氏制碱法”的原理:NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
如图是某兴趣小组在实验室中模拟“侯氏制碱法”制取NaHCO3所用到的主要装置。
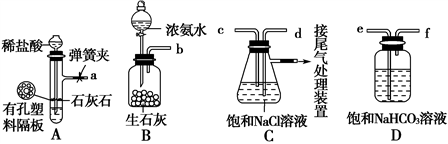
请回答下列问题:
①各仪器口的连接顺序为a接___________________________________接b,实验时先向NaCl溶液中通入较多的NH3,再通入足量的CO2,其原因是________(填字母)。
a.使CO2更易被吸收
b.NH3比CO2更易制取
c.CO2的密度比NH3大
②将生成的NaHCO3晶体从 混合物中分离出来需要的玻璃仪器是_______________。
混合物中分离出来需要的玻璃仪器是_______________。
③该兴趣小组用如图装置比较C、N、Si三种元素的非金属性强弱,B中的试剂是________,能说明碳的非金属性比硅强的实验现象是_______________________(H2SiO3是一种不溶于水的白色胶状物)。
-
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下:
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为____________________________________。
(2)“趁热过滤”的原因是_______________________________________。
(3)若在实验室进行“趁热过滤”,可采用的措施是__________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_______________。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________。
-
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺流程如下:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:

Ⅱ.有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液后过滤得到的滤渣中主要含有________(填写化学式)。25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8 时,c(Mg2+)∶c(Fe3+)=________。
(2)操作X为________,其温度应控制在_____________________________________
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由______________________________
________________________________________________________________________。
-
工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下:
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:(1)加入NaOH溶液时发生的离子反应方程式为▲ 、▲ 。
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)▲ 。
(3)“趁热过滤”时的温度应控制在▲ 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式▲ 。
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行▲ ,其理由是▲ 。