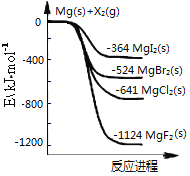
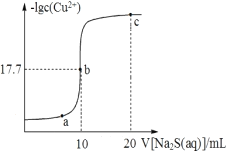
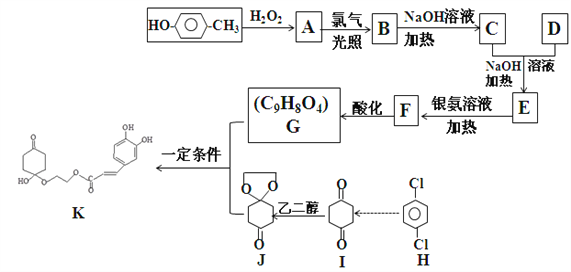
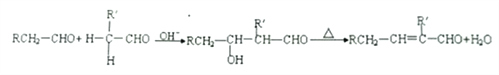
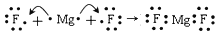-
《木草纲目》中“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”这里的“石碱”是指( )
A. K2CO3 B. KAl(SO4)2 C. KHCO3 D. KOH
难度: 简单查看答案及解析
-
2017年春节期间,一种“本宝宝福禄双全”的有机物刷爆朋友圈,其结构简式如下,该物质的同分异构体中具有“本宝宝福禄双全”谐音且两个醛基位于苯环间位的有机物有( )
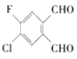
A. 4种 B. 6种 C. 7种 D. 9种
难度: 中等查看答案及解析
-
甲醇是重要的化工原料和燃料。将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g),图1是在两种投料比[c(CO2)/c(H2+CO)]分别为1:4 和1:6 时,CO2平衡转化率随温度变化的曲线,图2 是生成的甲醇/过氧化氢燃料电池的工作原理示意图:
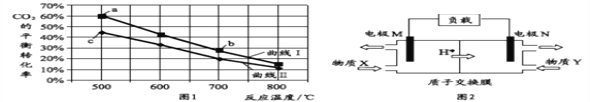
下列有关说法正确的是( )
A. 图2中电极M上发生还原反应
B. 图2中电极N的反应式:H2O2+2e−+2H+=2H2O
C. 图1中b点对应的平衡常数K值大于c点
D. 图1中a点对应的H2的转化率等于30%
难度: 中等查看答案及解析