-
化学与社会、生活密切相关,下列说法正确的是
A. 海水淡化的方法有蒸馏法、离子交换法、电渗析法等
B. 明矾水解时能生成具有吸附性的胶体粒子,故可用于消毒杀菌
C. Ba2+对人体无毒,故BaSO4在医学上可用作“钡餐”
D. 与铜质水龙头连接处的铁质水管不易发生腐蚀
难度: 中等查看答案及解析
-
下列关于有机物的叙述正确的是
A. 乙烯和苯都能使溴水褪色,褪色的原因相同
B. 分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸
C. 油脂和纤维素都是能发生水解反应的高分子化合物
D. 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应
难度: 中等查看答案及解析
-
中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:Na2CO3+2HCl═2NaCl+H2O+CO2↑
难度: 困难查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 25 ℃时,1 LpH = l的硫酸溶液中,含有H+的数目为0.2NA
B. 1 mol Na2O2与水完全反应时转移电子数目为2 NA
C. 向含1 mol Cl-的NH4Cl溶液中加入氨水使溶液呈中性,此时溶液中NH4+数目为NA
D. 向2 mL0.5 mol/L硅酸钠溶液中滴入过量盐酸制硅酸胶体,所得胶粒数目为0.001 NA
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是
选项
实验
现象
结论或解释
A
将0.1 mol·L-1MgSO4溶液滴入
过量NaOH溶液,再滴加几滴0.1 mol·L-1CuSO4溶液
先有白色沉淀生成,后有蓝色沉淀生成
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
B
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落下来
铝箔表面有致密Al2O3薄膜,Al2O3且熔点高于Al
C
向新收集的酸雨中滴加硝酸钡溶液
产生白色沉淀
酸雨中一定含有SO42-
D
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl)。工作一段时间后,两电极质量均增大。下列说法正确的是
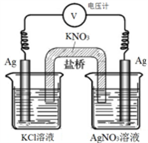
A. 右池中的银电极作负极
B. 总反应为Ag++Cl-=AgCl
C. 正极反应为Ag-e-=Ag+
D. 盐桥中的NO3-向右池方向移动
难度: 中等查看答案及解析
-
在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)
CH3OH(g) △H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的是
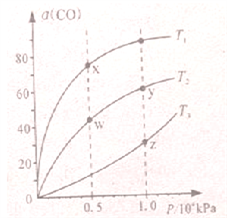
A. 反应温度:T1>T2
B. 正反应速率:υ正(y)= υ正(w)
C. 混合气体密度:ρ(x)>ρ(w)
D. 混合气体平均摩尔质量:M(y)<M(z)
难度: 困难查看答案及解析
