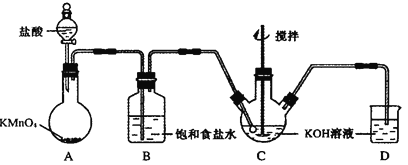
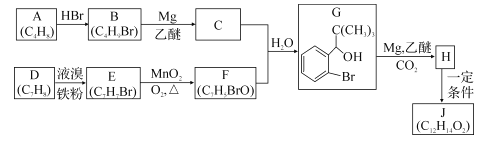
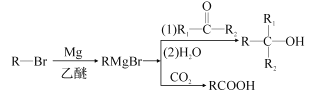
-
电子表电源常用微型银——锌电池,电极分别是Ag2O和Zn,电解液为KOH溶液,电极反应为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO,根据上述变化下列判断正确的是
A. Zn是负极,Ag2O是正极
B. Zn是正极,Ag2O是负极
C. 工作时电子由Ag2O极经外电路流向Zn极
D. 工作时,电池负极区溶液OH-浓度增大
难度: 困难查看答案及解析
-
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体.现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中正确的是( )
A. 肯定有SO2和NO
B. 肯定没有Cl2和NO2,一定有O2
C. 可能有Cl2和O2
D. 肯定只有NO
难度: 困难查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A. 使pH试纸显深蓝色的溶液:Ca2+、NH
、HCO
、Cl-
B. 室温下,KW/c(H+)=0.1 mol·L-1的溶液:Na+、K+、SiO
、NO
C. 含FeCl2的溶液:K+、Na+、SO
、AlO
D. 能与金属铝反应放出氢气的溶液:Mg2+、Na+、SO
、Cl-
难度: 困难查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgCl2(aq)
Mg(OH)2
MgO.
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
难度: 困难查看答案及解析
-
已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且
的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是
A. 若某温度下,反应后
=11,则溶液中
B. 参加反应的氯气的物质的量等于0.5amol
C. 改变温度,反应中转移电子的物质的量ne的范围:
amol≤ne≤
amol
D. 改变温度,产物中KC1O3的最大理论产量为
amol
难度: 困难查看答案及解析
-
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
(1)向溶液X中加入足量的Ba(OH)2溶液,得到白色沉淀:
(2)将(1)的反应混合液过滤,将足量盐酸加入沉淀中,沉淀部分溶解且产生气体。
下列说法正确的是
A. (2)中产生的气体可能CO2或SO2
B. 溶液X中一定存在SO42-、HCO3-、Mg2+
C. 溶液X中一定不存在Fe3+,可能存在Cl-
D. (1)中产生的白色沉淀一定含有BaSO4,可能含有BaSO3
难度: 困难查看答案及解析
-
NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍,工业上用C1O2气体制NaClO2的工艺流程如下:
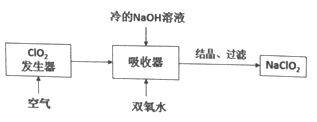
己知:NaClO2饱和溶液在低于38℃时析出NaC1O2·3H2O,高于38℃时析出NaClO2
下列说法不正确的是
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
C. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
难度: 困难查看答案及解析
-
25℃时,由酸(HM)及其盐(NaM)组成的混合溶液,起始浓度均为lmol·L-1。向该溶液中通入HC1气体或加入NaOH固体时,溶液pH的变化曲线如图所示。下列说法不正确的是

A. C点时,溶液中 c(Na+)=c(M-)
B. 将 D、E 点溶液混合后,c(M-)+c(HM)=2c(Na+)
C. B点时,溶液中 c(M-)>c(Na+)>c(HM)
D. A、B、C三点所表示的溶液中水电离出来的c(H+)逐渐增大
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2.24L甲烷气体中碳氢键的数目为0.4NA
B. lmolSO2与足量的O2反应,转移的电子数为2NA
C. 1 mol·L-1CH3COOH 与1 mol·L-1CH3COONa 溶液等体积混合,溶液中CH3COOH 和CH3COO-的总数为2NA
D. 7.8g乙炔与苯的混合物完全燃烧所消耗的O2分子数为0.75NA
难度: 困难查看答案及解析
-
某化学小组为探究固体颗粒的大小对反应速率的影响,设计了下列实验:
称取5.00g均匀的块状大理石(含有SiC2等不与盐酸反应的杂质)与50.0mL2.00mol·L-1稀盐酸混合,测得实验过程中逸出气体的质量并记录(假设只逸出CO2);再称量5.00g大理石粉末,重复以上实验操作。实验数据汇总如图。
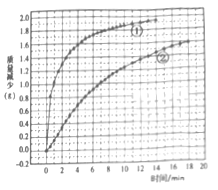
下列说法正确的是
A. 图中曲线①表示的是块状大理石与盐酸反应
B. 由图可知,如果等待的时间足够长,两条曲线应逐渐交汇
C. 大理石粉末与盐酸的实验中,0~8min内,盐酸的平均反应速率v(HCl)=1.64mol·L-1·min-1
D. 块状大理石与盐酸的实验中,13min时,CaCO3的消耗率为63.6%
难度: 困难查看答案及解析
-
常温下,下列说法正确的是
A. 0.1mol·L-1醋酸溶液与等浓度等体积的氢氧化钠溶液混合后,c(H-)>c(OH-)
B. 常温下,0.1 mol·L-1的盐酸和醋酸溶液的导电能力相同
C. 常温下,pH均为11的NaOH溶液和氨水中由水电离产生的c(OH-)均为1×10-11mol·L-1
D. 足量的锌分别与等体积的盐酸(pH=1)和醋酸(0.1 mol·L-1)反应,收集到相同条件下的气体体积不相同
难度: 困难查看答案及解析
-
—种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是
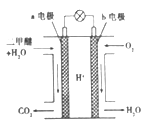
A. a电极是该电池的负极
B. b电极上发生的反应为:O2+4H++4e-=2H2O
C. H+由a电极向b电极迁移
D. 电池工作时,电子从a电极→灯泡→b电极→电解液→a电极
难度: 困难查看答案及解析
-
常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示。下列叙述正确的是
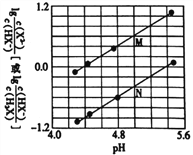
A. Kal(H2X)的数量级为10-7
B. 曲线N表示lg
与pH的变化关系
C. NaHX溶液中:c(H+)<c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-)
难度: 困难查看答案及解析
-
某工厂用电解法处理含有SO2的尾气,其装置如图所示(电极材料均为惰性电极)。下列说法不正确的是
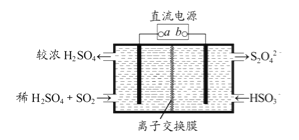
A. 电极a连接的是电源的正极
B. 若电路中转移0.03mole-,则离子交换膜左侧溶液中增加0.03mol离子
C. 图中的离子交换膜是阳离子交换膜
D. 阴极的电极反应式为2HSO3-+2e-+2H+==S2O42-+2H2O
难度: 困难查看答案及解析
-
实验室用H2还原SiHCl3(沸点:31.85℃)制备纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )
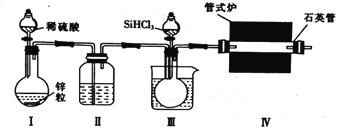
A. 装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水
B. 实验时,应先加热管式炉,再打开盛装稀硫酸的分液漏斗
C. 为鉴定制得的硅中是否含微量铁单质,需要用到的试剂为盐酸、双氧水、硫氰化钾溶液
D. 该实验中制备氢气的装置也可用于氧氧化钠稀溶液与氯化铵固体反应制备氨气
难度: 困难查看答案及解析
-
已知:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是
A. 若产物为NaClO、NaCl,则吸收后的溶液中n(ClO-)=n(Cl-)
B. 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
C. 若产物为NaClO、NaClO3、NaCl,则由吸收后的溶液中n(Cl-)和n(ClO-)可计算吸收的n(Cl2)
D. 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
难度: 困难查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温常压下,11.2LCO2所含有的分子数为0.5NA
B. 标准状况下,18g水含有的氢原子数为NA
C. Imol/L的NaOH溶液中含有的Na+数为NA
D. 78g过氧化钠与足量的二氧化碳反应,转移的电子数目为NA
难度: 困难查看答案及解析
-
已知:AgOH很不稳定,易分解生成Ag2O(黑色)。溶液X中可能含有下列离子:Ag+,NH4+、Fe3+、SO42-、SO32-、Cl-中的几种离子。为了确定其组成,某同学进行了如下实验:

下列说法不正确的是( )
A. 溶液X与NaOH反应生成红褐色沉淀A,可推测该溶液中不存在SO32-
B. 溶液X中一定不含Ag+
C. 溶液X中一定存在NH4+、Fe3+、SO42-
D. 取少量溶液B,加入AgNO3溶液,若有沉淀产生,则有Cl-
难度: 困难查看答案及解析
-
在25℃时,向l0mL0.01mol·L-1NaA溶液中逐滴加入0.01mol·L-1的盐酸,滴定曲线如下图所示,下列说法正确的是( )

A. a点到c点的过程中,c(HA)+c(A-)=0.01mol·L-1等式始终成立
B. b点时,溶液中微粒浓度大小的关系:c(A-)>c(Cl-)>c(HA)>c(OH-)>c(H+)
C. c点溶液存在的关系:c(Na+)+c(H+)=c(HA)+c(OH-)+2c(A-)
D. 由图可知,等浓度的HA、NaA混合溶液中,HA的电离程度大于A-的水解程度
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 12g金刚石含有的C-C键数为2 NA,6.0g二氧化硅含有的Si-O键数为0.4NA
B. lmol硫在空气中完全燃烧生成SO3消耗的氧气分子数为3NA
C. 常温常压下,2.24LCO2和N2O混合物中所含有的原子数为0.3NA
D. 4.6g金属钠与500mL0.2mol·L-1的盐酸充分反应,转移电子数为0.1NA
难度: 困难查看答案及解析