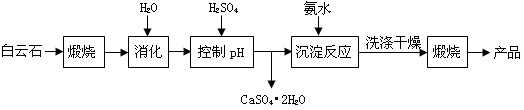
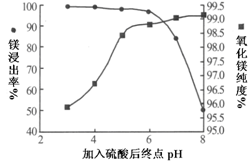
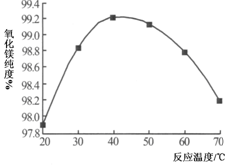
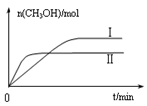
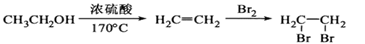-
随着社会的发展,人们日益重视环境问题。下列做法或说法正确的是
A.提倡使用一次性发泡塑料餐具和塑料袋
B.绿色化学的核心是应用化学原理治理环境污染
C.推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染
D.PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.苯甲醛:
B.Mg2+的结构示意图:
C.CO2的电子式:
D.核内有8个中子的碳原子:
C
难度: 中等查看答案及解析
-
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO3-
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
难度: 中等查看答案及解析
-
下列有关物质性质的应用正确的是
A.常温下干燥氯气与铁不反应,可以用钢瓶储存氯水
B.二氧化硅具有较强的导电性,可用于制造光导纤维
C.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
D.次氯酸钠具有强氧化性,可用于配制消毒液
难度: 简单查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是
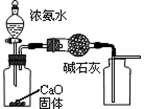
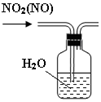
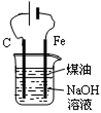
图1 图2 图3 图4
A.用图1装置制取并收集干燥纯净的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq)
AlCl3
Al ② NH3
NO
HNO3
③NaCl(饱和)
NaHCO3
Na2CO3 ④FeS2
SO3
H2SO4
A.②③ B.①④ C.②④ D.③④
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为0.1 NA
B.标准状况下,22.4L甲苯中含C—H数目为8 NA
C.常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1NA
D.0.1mol Na2O2与足量CO2反应时,转移的电子数目为0.2 NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.工业电解饱和食盐水:2Cl-+H2O=Cl2↑+H2↑+OH-
B.碳酸钠的水【解析】
CO32-+2H2OH2CO3+2OH-
C.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-=AlO2-+2H2O
D.用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O
难度: 中等查看答案及解析
-
二甲醚是一种绿色、可再生的新能源。如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法不正确的是
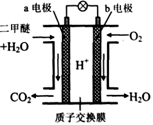
A.a电极为该电池负极
B.O2在b电极上得电子,被氧化
C.电池工作时,a电极反应式:
CH3OCH3—12e-+3H2O→2CO2↑+12H+
D.电池工作时,燃料电池内部H+从a电极移向b电极
难度: 中等查看答案及解析
-
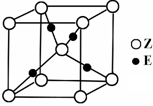
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
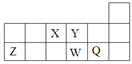
A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
难度: 困难查看答案及解析
-
下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能发生,则该反应的△H>0
B.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
难度: 中等查看答案及解析
-
霉酚酸酯(MMF)
是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应:
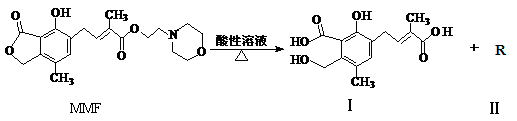
下列说法中正确的是
A.MMF分子中含有三种官能团
B.可以用NaHCO3溶液区别MMF与化合物Ⅰ
C.化合物Ⅱ分子中只含碳、氢元素,属于烃类
D.1molMMF与足量NaOH 溶液共热,最多可消耗3molNaOH
难度: 困难查看答案及解析
-
下列依据相关实验得出的结论正确的是
A.向FeCl2溶液中滴加少量KSCN溶液变血红色,说明FeCl2完全被氧化成FeCl3
B.向某溶液中加入稀硝酸再滴入Ba(NO3)2溶液产生白色沉淀,该溶液一定含SO42-
C.向漂白粉上加入较浓的盐酸,产生的气体不能使湿润淀粉碘化钾试纸变蓝,说明该漂白粉已经失效
D.向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)<Ksp(AgI)
难度: 中等查看答案及解析
-
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH4+)>c(SO42-)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)
2XY3(g) △H=-92.6kJ·mol-1
起始时各物质物质的量如下表所示:
容器
编号
起始时各物质物质的量/mol
X2
Y2
XY3
①
1
3
0
②
0.6
1.8
0.8
达到平衡后,①容器中XY3的物质的量为0.5mol。下列叙述正确的是
A.容器①、②中反应的平衡常数不相等
B.达平衡时,容器②中 XY3的物质的量浓度为2mol·L—1
C.容器①中反应达到平衡时放出的热量为23.15 kJ
D.容器②中反应达到平衡时放出热量
难度: 中等查看答案及解析
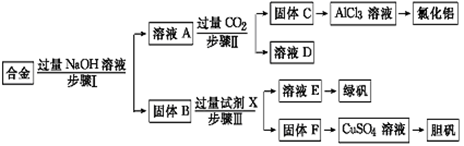
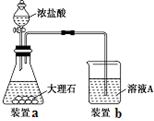

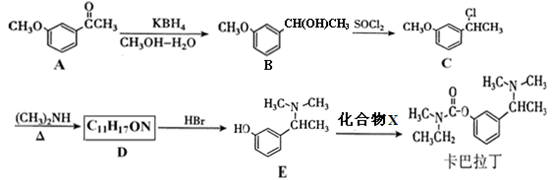
 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: