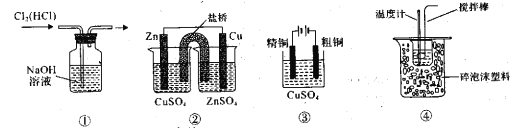
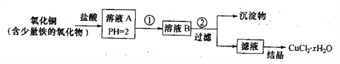
-
室温时,关于相同体积pH均为3 的醋酸和盐酸,下列说法正确的是
A. 稀释10倍后,两者的pH 变化醋酸大于盐酸
B. 加入一定量的锌粉,产生气体的体积相同,则醋酸一定过量
C. 两溶液中H2O的电离程度: 醋酸>盐酸
D. 加入足量的锌粉,最终产生氢气的量相等,但反应速率醋酸较慢
难度: 中等查看答案及解析
-
下列叙述涉及的化学相关知识,其中不正确的是
A. 打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释
B. 用铁质自来水管与铜质水龙头连接使用时,连接处的铁水管锈蚀更快
C. 1g氢气在氧气中完全燃烧生成气态水,放出的热量为120.9kJ,氢气的燃烧热大于241.8kJ·mol-1
D. 海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.1mol/L醋酸溶液中含有醋酸分子的数目为0.1NA
B. 25℃时,1LpH=12的Na2CO3溶液中含有Na+的数目为0.2NA
C. 常温下,20LpH=12的Na2CO3溶液中含有OH-数目为0.2NA
D. 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子数目为0.6NA
难度: 中等查看答案及解析
-
下列对定量实验误差分析正确的是
A. 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中——测定结果无影响
B. 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡——测定结果偏高
C. 测定溶液pH 的实验中,用湿润的pH 试纸测定某溶液的pH——测定结果偏高
D. 现需90mL1.0mo/LNaOH溶液,称取3.6gNaOH固体配制——溶液浓度偏低
难度: 中等查看答案及解析
-
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
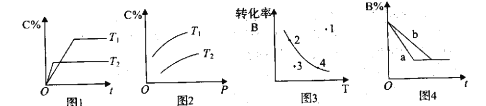
A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2 可知,该反应m+n<p
C. 图3中,点3的反应速率V正>V逆
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 中等查看答案及解析
-
将少量V2O5 及一定量Ag2SO4 固体置于恒容真空密闭容器,在一定温度下发生反应: Ag2SO4(s)
Ag2O(s) + SO3(g) 2SO3(g)
2SO2(g) + O2(g),10min 后反应达平衡,此时c(SO3)=0.4mol/L,c(SO2)=0.1mol/L。下列说法中,不正确的是
A. 平衡时,容器内气体密度为40g/L。
B. 10min 内氧气的平均反应速率为0.005mol·(L·min)-1
C. 再加入少量AgSO4 固体,则反应均向正反应方向移动
D. 该温度下,2Ag2SO4(s)
2Ag2O(s) +2SO2(g) +O2(g)的平衡常数为5×10-4
难度: 中等查看答案及解析
-
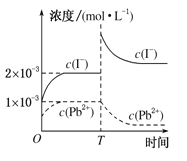
常温时,ksp(CaC2O4)=2.4×10-9,下列有关0.10mol/L 草酸钠(Na2C2O4) 溶液的说法,正确的是
A. 溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+)
B. 若向溶液中不断加水稀释,溶液中各离子浓度均减小
C. 若用pH计测得此溶液的pH=a,则H2C2O4的第二级电离平衡常数约为Ka2=1013-2a
D. 若向该溶液中加入等体积CaCl2溶液后能够产生沉淀,则CaCl2溶液的最小浓度应该大于2.4×10-8 mol/L
难度: 中等查看答案及解析
-
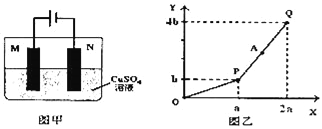
某同学组装了如图所示的电化学装置,电极I为A1,其他均为Cu,则
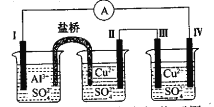
A. 电流方向: 电极IV→
→电极I
B. 电极I发生还原反应
C. 电极Ⅱ逐渐溶解
D. 电极III的电极反应: Cu2++2e-=Cu
难度: 中等查看答案及解析
-
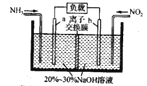
一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH 表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是
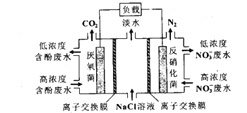
A. 右室电极为该电池的正极
B. 左室电极反应式可表示为: C6H5OH -28e-+11H2O=6CO2↑+28H+
C. 右室电极附近溶液的pH减小
D. 工作时左侧离子交换膜为阴离子交换膜,右侧离子交换膜为阳离子交换膜
难度: 中等查看答案及解析
-
根据下列实验事实,不能得到相应结论的是
选项
实验操作和现象
结论
A
向醋酸溶液中滴加少量Na2SiO3溶液,观察到白色沉淀
醋酸的酸性强于H2SiO3
B
向均盛有2mL5% H2O2溶液的两支试管中分别滴入0.2mol/LFeCl3和0.3mol/LCuCl2溶液各1mL,前者生成气泡的速率更快
催化效果: Fe3+> Cu2+
C
向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢
反应产生气泡速度变化,是因为醋酸电离平衡先正向移动,再逆向移动
D
常温下分别测等浓度的醋酸和氨水pH,二者的pH 分别为2和12
常温下,醋酸和氨水的电离平衡常数相等
A. A B. B C. C D. D
难度: 中等查看答案及解析