-
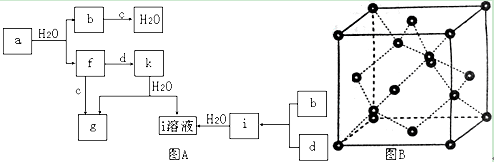
有四种晶体,其离子排列方式如下图所示,其中化学式不属AB型的是( )
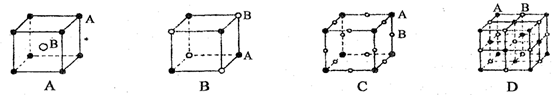
难度: 中等查看答案及解析
-
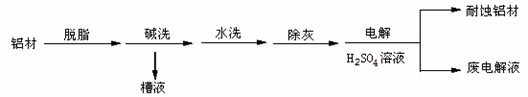
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是( )
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同
D.AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同
难度: 中等查看答案及解析
-
元素周期表中铋元素的数据见图,下列说法正确的是( )
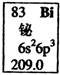
A.Bi元素的质量数是209
B.Bi元素的相对原子质量是209.0
C.Bi原子6p亚层(能级)有一个未成对电子
D.Bi原子最外层有5个能量相同的电子
难度: 简单查看答案及解析
-
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符合的是
A.大力研发新型有机溶剂替代水作为萃取剂
B.加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率
C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
D.甲烷和乙醇的燃烧热分别是891.0 kJ·mol-1、1366.8 kJ·mol-1,利用甲烷更“低碳”
难度: 中等查看答案及解析
-
在中学化学实验中使用的玻璃、陶瓷等仪器,在实验操作中不能承受温度的急剧变化,否则会引起安全事故。下列实验操作过程不是基于上述原因的是( )
A、用排水法收集气体后,先移出导气管,后熄灭酒精灯
B、在用二氧化锰和浓盐酸制氯气时,在加入二氧化锰后应首先加入浓盐酸,然后再点燃酒精灯
C、在用固体氯化铵和氢氧化钙制取氨气结束后,将大试管从铁架台上取下置于石棉网上冷却后再洗涤
D、钠与水反应时,只能取黄豆粒大小的钠投入盛水的烧杯中反应
难度: 中等查看答案及解析
-
下列各组描述正确的是
A.化工生产要遵守三原则:充分利用原料、充分利用能量、保护环境。 ①燃烧时使用沸腾炉 ②制盐酸时将氯气在氢气中燃烧 ③制硫酸时使用热交换器 这3种化工生产分别符合以上某原则
B.① 用燃烧的方法鉴别甲烷、乙烯和乙炔 ②用酒精萃取溴水中的溴 ③ 用水鉴别硝酸铵和氢氧化钠固体 ④用互滴法鉴别Na2CO3、盐酸、BaCl2、NaCl四种溶液 以上均能达到实验目的
C.①用硫粉覆盖地下撒有的汞 ②金属钠着火用泡沫灭火器或干粉灭火器扑灭 ③用热碱溶液洗去试管内壁的硫 ④用湿的红色石蕊试纸检验氨气是否集满 以上操作均合理
D.①过氧化氢:火箭燃料 ②碳酸氢钠: 食品发酵剂 ③钠:制氢氧化钠 ④硫酸:制蓄电池 以上物质的用途均合理
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的组合是 ( )
a 12 g 金刚石中含有的碳碳键的数目为2NA
b 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1 mol·L-1的NH4NO3溶液中含有氮原子的数目为2 NA
e 标准状况下,2.24 L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol • L-1 AlCl3溶液中阳离子总数大于0.1NA
A.a c f h B.a c e g C.a c e f h D.b d e h
难度: 困难查看答案及解析
-
以下食品化学知识的叙述不正确的是
A、食盐可作调味剂,也可作食品防腐剂
B、新鲜蔬菜做熟后,所含维生素C会有损失
C、纤维素在人体内可水解为葡萄糖,故可做人类的营养物质
D、葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒
难度: 中等查看答案及解析
-
下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S;②原子半径:Na>Mg>O;③沸点:H2Se>H2S>H2O;④结合H+能力:OH->CH3COO->I-
A.①③ B.②③ C.①④ D.②④
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g)= 2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2
难度: 中等查看答案及解析
-
在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
A.Fe2S3、I2 B.Al(OH)3、I2
C.Fe(OH)3、Al(OH)3 D.FeS、S、Al(OH)3
难度: 中等查看答案及解析
-
在预防甲型H1N1流感疫情时,防疫部门使用了含氯类消毒剂,其中的氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4—5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是
A.氯胺水解产物为NH2OH(羟氨)和HCl
B.氯胺的消毒原理与漂白粉相似
C.氯胺中氯的化合价为+1
D.氯胺的电子式为
难度: 中等查看答案及解析
-
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
A.X元素的氢化物的水溶液显碱性
B.Z元素的离子半径大于W元素的离子半径
C.Z元素的单质在一定条件下能与X元素的单质反应
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
难度: 困难查看答案及解析
-
某溶液可能含有Clˉ、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
由此可知原溶液中
A.至少存在5种离子
B.Clˉ一定存在,且c(Clˉ)≥0.4mol/L
C.SO42ˉ、NH4+、一定存在,Clˉ可能不存在
D.CO32ˉ、Al3+一定不存在,K+可能存在
难度: 困难查看答案及解析
-
已知
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
A、反应中硫酸作氧化剂 B、
中硫元素被氧化
C、刺激性气味的气体是氨气 D、1mol
完全反应转移0.5mol电子
难度: 中等查看答案及解析
-
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。若将2.00 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是( )
A.反应后的固体混合物中Cu的质量为1 2.8 g
B.反应后的固体混合物中还含有碳
C.反应后的固体混合物总质量为14.4 g
D.反应后的固体混合物中氧化物的物质的量为0.05mol
难度: 中等查看答案及解析
-
如图表示在某溶液中滴加Ba(OH)2溶液时,生成的沉淀的物质的量随Ba(OH)2溶液的体积变化关系。该溶液的成分可能是
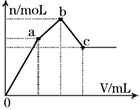
A.NH4Al(SO4)2 B.KAl(SO4)2
C.Al2(SO4)3 D.Na2SO4与NaAlO2组成的混合物
难度: 中等查看答案及解析
-
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,能层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
A.Z与Y形成的化合物可作为耐高温材料
B.WY2能与碱反应,但不能与任何酸反应
C.原子半径按X、Y、Z、R、W的顺序依次增大
D.熔沸点:X2R>X2Y
难度: 中等查看答案及解析
-
短周期元素X、Y、Z和W的原子序数依次增大。X原子的S能级电子总数是P能级电子总数的2倍,Y与X同主族,Z和W原子中未成对电子数之比为2∶1。下列说法错误的是( )
A.XW4为非极性分子
B.Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W
C.X、Y的氢化物由固态转化为气态时,克服相同的作用力
D.XW4、YW4、ZW2分子中的中心原子均为sp杂化
难度: 中等查看答案及解析
-
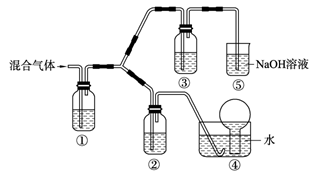
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )

A、洗气瓶中产生的沉淀是
B、在Z导管出来的气体中无
C、洗气瓶中产生的沉淀是
D、在Z导管口有红棕色气体出现
难度: 中等查看答案及解析
-
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
A.M B.M2+ C.M3+ D.MO2+
难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、
Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是( )
A.离子半径:Y>X B.气态氢化物的稳定性:Z>X
C.Y的氧化物中含有离子键 D.Z的氧化物对应的水化物是弱碱
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及某些化合价见下表,下列说法正确的是 ( )
元素代号
A
B
D
E
G
H
I
J
化合价
–1
–2
+4、–4
+7、–1
+5、–3
+3
+2
+1
原子半径/nm
0.071
0.074
0.077
0.099
0.110
0.143
0.160
0.186
A.A的单质能将E单质从HE3的溶液中置换出来
B.A、H、J的离子半径由大到小顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物
难度: 中等查看答案及解析
-
下列物质性质的变化规律,与共价键的键能大小无关的是( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低
④NaF、NaCl、NaBr、NaI的熔点依次降低
A.仅② B.①④ C.②③ D.①②③
难度: 中等查看答案及解析