-
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是
A. 保持表面干燥 B.表面镀锌 C. 表面镶嵌铜块 D. 与电源负极相连
难度: 中等查看答案及解析
-
用石墨作电极电解1 mol·L-1下列物质的溶液,溶液的pH保持不变的是
A.HCl B.NaOH C.NaCl D. Na2SO4
难度: 中等查看答案及解析
-
某同学组装了如图所示的原电池装置,下列叙述中正确的是

A.电流方向:电极Ⅱ→
→电极Ⅰ
B.电极Ⅱ逐渐溶解
C.电极Ⅰ上发生还原反应
D.盐桥中装有含氯化钾的琼脂,Cl¯向右池移动
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.用排饱和食盐水的方法收集氯气
B.在沸腾的蒸馏水中滴加FeCl3溶液,制Fe(OH)3胶体
C.在FeCl3溶液中加AgNO3溶液,产生白色沉淀
D.向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,白色固体转化为黑色固体
难度: 中等查看答案及解析
-
常温下用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是
A.溶液中的c(CH3COO-) B.溶液中的c(H+)
C.醋酸的电离平衡常数 D.溶液中的c(OH-)
难度: 简单查看答案及解析
-
下列关于铜电极的叙述中正确的是
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阳极
C.在铁上电镀铜时用铜作阴极
D.电解稀硫酸时用铜作阳极,阳极产生氧气
难度: 中等查看答案及解析
-
对于反应C(s)+H2O(g)⇌CO(g)+H2(g);△H>0,下列有关说法正确的是
A.升高体系温度,平衡常数K减小
B.增大体系压强,平衡常数K不发生变化
C.平衡常数表达式为K=
D.增加C(s)的量,平衡正向移动
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.Na2S溶液的水【解析】
S2-+ 2H2OH2S + 2OH-
B.NaHCO3溶液的电离:HCO3-+ H2O
H2 CO3+ OH-
C.NH4Cl溶液的水【解析】
NH4+ + H2ONH3·H2O + H+
D.泡沫灭火器灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
难度: 简单查看答案及解析
-
下列各组离子在指定的条件下一定能大量存在的是
A.在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl-
B.常温下由水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3-
C.有Fe3+存在的溶液中:CO32-、 NH4+、SO42-、Cl-
D.在能使石蕊试纸变蓝色的溶液中:Na+、K+、S2-、CO32-
难度: 中等查看答案及解析
-
已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3(均为正值)。下列关系式中正确的是
A.Q1<Q3<Q2 B.Ql<Q2<Q3
C.Q1<Q2=Q3 D.Q1=Q2=Q3
难度: 简单查看答案及解析
-
电解质溶液有许多奇妙之处,下列关于电解质溶液的叙述中正确的是
A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
B.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH)前者小于后者
C.常温下,某溶液中由水电离出的c(H+)=10-5mol·L-1,则此溶液可能是盐酸
D.常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 简单查看答案及解析
-
下列说法一定正确的是
A.反应A(s)
2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态
B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀
C.用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
D.增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率
难度: 简单查看答案及解析
-
下列说法正确的是
A.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H不相同
B.用pH试纸测定新制氯水的pH
C.已知:①2H2(g) +O2 (g) =2H2O (g) △H1
②2H2(g)+O2 (g)= 2H2O(1) △H2,则△H1<△H2
D.在中和滴定实验中,用待测NaOH溶液润洗锥形瓶,测定结果将偏高
难度: 简单查看答案及解析
-
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中正确的是
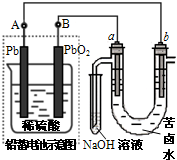
A.铅蓄电池负极的反应式为:Pb-2e -→ Pb2+
B.铅蓄电池放电时,该电池两极质量均减少
C.铅蓄电池充电时,B极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
难度: 简单查看答案及解析
-
已知水的电离方程式:H2O
H+ + OH-,下列叙述中正确的是
A.升高温度,KW增大,pH不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.室温下向水中加入少量硫酸,c(H+)增大,KW不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
难度: 简单查看答案及解析
-
在容积不变的密闭容器中,一定条件下发生反应:2A ⇌ B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.若向容器中充入惰性气体,则平衡向右移动
D.物质A一定为非气态,且正反应是吸热反应
难度: 简单查看答案及解析
-
在25℃时,将0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合后,测得混合溶液pH=8,则下列所表示的该混合溶液中有关微粒的浓度关系中,错误的是
A.c(HA)+c(A-)=c(Na+)=0.1 mol·L-1
B.c(Na+)-c(A-)=c(OH-)-c(H+)
C.c(Na+)>c(A-)>c(OH-)>c(H+)
D.c(OH-)=c(H+)+c(HA)
难度: 简单查看答案及解析
-
图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是



图1 图2 图3 图4
A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
C.图3表示分别稀释1 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL
D.图4表示平衡2NO2(g)
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
难度: 中等查看答案及解析
-
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,下列有关说法中,正确的是
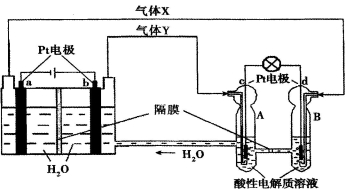
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e-==2H2↑+4OH-
C.c极上发生的电极反应是:O2+4H++4e-==2H2O
D.d极上进行还原反应,产生的H+可以通过隔膜进入A
难度: 简单查看答案及解析
-
醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,下列叙述不正确的是
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO‾)
B.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH =7
C.CH3COOH溶液中加入少量CH3COONa固体.平衡逆向移动
D.室温下向pH=3的醋酸溶液中加水稀释,溶液中
不变
难度: 困难查看答案及解析


 的值
的值