-
(1)室温下,以惰性电极电解100 mL 0.1mol/LNaCl溶液,写出电解总反应的化学方程式 ;若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(2)25℃时,在浓度均为1mol/L的三种溶液:a (NH4)2SO4、b (NH4)2CO3、c (NH4)2Fe(SO4)2中,c(NH4+)由大到小的顺序是 (用a、b、c表示)
(3)已知反应2HI(g) = H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为______________kJ。
高二化学填空题中等难度题查看答案及解析
-
(1)室温下,以惰性电极电解100 mL 0.1mol/LNaCl溶液,写出电解总反应的化学方程式______________________________________;若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为_________(忽略反应前后溶液的体积变化)。
(2)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。盛装0.2000 mol/L盐酸标准液应该用________式滴定管;用盐酸滴定待测液NaOH,滴定终点时的颜色变化是____________________且30s不变色;滴定前用待测液润洗锥形瓶,则所测NaOH溶液的浓度___________(填“无影响”、“偏高”或“偏低”下同);若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度值___________。
高二化学综合题中等难度题查看答案及解析
-
(8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是________。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
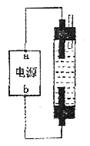
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极'b为阳极;HClO和NaCl
假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
________。
高二化学填空题简单题查看答案及解析
-
将0.1 mol AgNO3和0.2mol Cu(NO3)2固体溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.15 mol O2,此时,另一极上析出的气体体积(标准状况)为( )
A.1.12L B.2.24 L C.3.36 L D.4.48L
高二化学选择题中等难度题查看答案及解析
-
用惰性电极电解100mLNaCl溶液,一段时间内,阴阳两极生成的气体(氢气、氯气)反应后生成的气体产物HCl恰好可中和0.01mol/L的NaOH溶液100mL,若不考虑溶液体积的变化,则此时电解液的pH为
A. 1 B. 2 C. 12 D. 13
高二化学单选题中等难度题查看答案及解析
-
用惰性电极电解CuSO4溶液,一段时间后取出电极。向电解后的溶液中加入0.1mol的Cu(OH)2,充分反应后所得溶液与电解前相同,则电解时电路中通过电子的物质的量是( )
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
高二化学单选题中等难度题查看答案及解析
-
下列实验或做法对应的方程式不正确的是
A.室温下用 pH 试纸测得 0.1 mol·L-1 醋酸溶液的 pH 为 3: CH3COOH⇌CH3COO-+ H+
B.用石墨电极电解食盐水的阳极电极反应式:2Cl--2e-=Cl2↑
C.向Na2CO3溶液中滴入酚酞试液呈红色:CO32-+2H2O⇌H2CO3 +2OH-
D.向0.1 mol·L-1、pH=1 的 KHA 溶液中加入 KOH 溶液:H++OH-=H2O
高二化学单选题中等难度题查看答案及解析
-
将0.2 mol AgNO3、0.4 mol Cu(NO3)2和0.6 mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.3 mol Cu,此时,另一极上的气体体积(标准状况)为( )
A. 4.48 L B. 5.6 L C. 6.7 L D. 7.8 L
高二化学选择题中等难度题查看答案及解析
-
将0.2 mol AgNO3、0.4 mol Cu(NO3)2和0.6 mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.3 mol Cu,此时,另一极上的气体体积(标准状况)为( )
A.4.48 L B.5.6 L C.6.7 L D.7.8 L
高二化学单选题中等难度题查看答案及解析
-
将0.2 mol AgNO3、0.4 mol Cu(NO3)2和0.6 mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.3 mol Cu,此时,另一极上的气体体积(标准状况)为
A.4.48 L B.5.6 L C.6.72 L D.7.8 L
高二化学选择题中等难度题查看答案及解析