-
今年4月26日,中国第一艘国产001A型航母顺利完成下水,有盐分的海水和空气会对船体造成腐蚀,因此船体的防腐处理非常重要。下列关于金属腐蚀和防腐的说法错误的是( )
A. 海上舰艇的腐浊主要为金属的化学腐蚀
B. 可以在船舶外克装上锌块,用牺牲阳极的阴极保护法防止金属腐蚀
C. 刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀
D. 外加电流,将需要保护的金属做阴极,可以起到保护金属的作用
难度: 中等查看答案及解析
-
下列溶液中,溶质的阴离子和阳离子的物质的量浓度相等的是( )
A. NaHSO3 B. CH3COONa C. NaCl D. MgSO4
难度: 中等查看答案及解析
-
常温下,甲溶液的pH是3,乙溶液的pH是4,甲溶液与乙溶液的c(OH-)之比为( )
A. 3∶4 B. 4∶3 C. 10∶1 D. 1∶10
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g)在不同情况下的反应速率,其中的反应速率最快的是
A. v(A)=0.20 mol/(L·s) B. v(B)=0.30 mol/(L·s)
C. v(C)=0.50 mol/(L·s) D. v(D)=0.60 mol/(L·s)
难度: 中等查看答案及解析
-
对于反应C(s) + H2O(g)
CO(g) + H2(g) △H>0,下列措施既能加快正反应速率,又能使化学平衡向正反应方向移动的是( )
A. 增大H2O(g)浓度 B. 使用催化剂 C. 增大压强 D. 增加C的用量
难度: 困难查看答案及解析
-
在一定温度下,2HI(g)
H2(g)+I2(g) △H>0的反应达到平衡,下列条件的改变将使混含气体颜色加深的是( )
A. 降低HI的浓度 B. 升高反应温度 C. 增大容器体积 D. 增大氢气浓度
难度: 困难查看答案及解析
-
在相同温度、不同压强(P1<P2)下,可逆反应2X(g)
2Y(g)+Z(g)的生成物Z在反应混合物中的体积分数(Z%)与反应时间(t)的关系有以下图示,其中正确的是( )
A.
 B.
B. 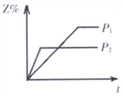
C.
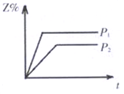 D.
D. 
难度: 中等查看答案及解析
-
T℃时,反应A(g)+B(g)
2C(g)的化学平衡常数K为100,则T℃时,反应C(g)
A(g)+
B(g) 的化学平衡常数K为( )
A. 100 B. 0.01 C. 0.1 D. 1
难度: 中等查看答案及解析
-
某化学反应其△H= -122 kJ/mol,△S=231J/(mol·K),则下列哪种情况下该反应可自发进行( )
A. 仅在低温下可以自发进行 B. 在任何温度下都不能自发进行
C. 仅在高温下可以自发进行 D. 在任何温度下都能自发进行
难度: 中等查看答案及解析
-
已知2H2O2(l)=2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法错误的是( )

A. 该反应是放热反应
B. 途径Ⅱ与途径Ⅰ相比,可能是加了催化剂
C. 其他条件相同时,产生相同体积氧气放出的热量:途径Ⅰ>途径Ⅱ
D. 其他条件相间时,产生相同体积氧气所需的时间:途径Ⅰ>途径Ⅱ
难度: 困难查看答案及解析
-
一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。若要配制1 mol·L-1的稀硫酸标准溶液,用其滴定某未知浓度的NaOH溶液。下列有关说法错误的是( )
A. 实验中用到的滴定管和容量瓶仵使用前都需要检漏
B. 如果实验需用85 mL的稀硫酸标准溶液,配制时可选用100 mL容量瓶
C. 用甲基橙作指示剂,滴定终点时,溶液颜色从红色变为橙色
D. 酸式滴定管用蒸馏水洗涤后,即裝入标准浓度的稀硫酸滴定,会导致测定的NaOH溶液浓度偏大
难度: 困难查看答案及解析
-
《科学美国人》评出2016年十大创新技术:碳呼吸电池、量子卫星、万能抗病毒药……,“碳呼吸电池”是一种新型能源装置,其工作原理如图。下列有关说法错误的是( )
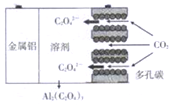
A. 该装置是将化学能转变为电能
B. 金属铝是负极,多孔碳是正极
C. 正极的电极反应为2CO2-2e-=C2O42-
D. 将电池配备在火力发电站和汽车排气管上,不但可减少 CO2排放,而且还可以利用CO2
难度: 困难查看答案及解析
-
以石墨为电极,电解KI溶液(其中含有少量酚酞)。下列说法正确的是( )
A. 阴极逸出气体 B. 阳极附近溶液呈红色
C. K+向阳极迁移 D. 溶液的pH逐渐变小
难度: 困难查看答案及解析
-
下列事实中,不能证明NH3·H2O为弱碱的是( )
A. Al(OH)3不溶于氨水 B. NH3·H2O 和CH3COOH反应
C. 常温,0.1mol/L NH3·H2O溶液pH小于13 D. 常温,0.1mol/L NH4Cl溶液的pH小于7
难度: 困难查看答案及解析
-
将CH3COOH溶液逐滴加入到NaOH溶液中,至溶液为中性。此时溶液中( )
A. c(CH3COO-)=c(Na+) B. c(CH3COOH)< c(Na+)
C. c(CH3COO-)>c(Na+) D. c(CH3COO-)和c(Na+)的大小无法比较
难度: 中等查看答案及解析
-
25℃时,下列有关电解质溶液的说法正确的是( )
A. 将NaOH溶液用水稀怿,pH变大
B. 将PH=4的醋酸溶液稀释到原体积的10倍后,溶液的pH=5
C. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
D. 分别用PH = 2的CH3COOH溶液和盐酸中和等物质的量的NaOH,消牦CH3COOH溶液和盐酸的体积相等
难度: 困难查看答案及解析
-
常温,下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A. 溶质的电离方程式为NaHCO3=Na++H++CO32-
B. 25℃时加水稀释后,溶液中c(H+)与c(OH-)的乘积变大
C. 0.10 mol·L-1NaHCO3溶液pH小于0.10 mol·L-1Na2CO3溶液pH
D. 0.10 mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
难度: 困难查看答案及解析
-
下列实验操作能达到实验目的的是( )
选项
实验目的
实验操作
A
探究浓度对化学平衡的影响
向盛有2.5mL 0.005mol/L FeCl3,溶液的试管中加入 2.5mL 0.01 mol/L KSCN溶液,再滴加4滴饱和FeCl3溶液
B
从AlCl3溶液提取无水AlCl3
将AlCl3溶液灼烧蒸干
C
证明Ksp(AgCl)>Ksp(AgI)
在2mL 0.01 mol/LAgNO3溶液中滴加1mL 0.1 mol/LNaCl溶液,再滴加lmL 0.1 mol/LKI溶液
D
配制澄淸的FeCl3浓溶液
将FeCl3固体置入少量水中搅拌
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
在10 L的密闭容器中,A、B、C 三种物质的物质的量(n)与时间(t)的关系如图一所示,C的百分含量(C%)与温度(T)的关系如图二所示,下列分析错误的是( )
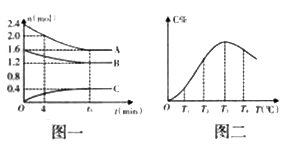
A. 该反应的化学方程式是2A+B
C
B. 0~4 min时,A的平均反应速率为0.1 mol/(L·min)
C. 由T1向T2变化时,v(正)>v(逆)
D. 平衡后升高温度,反应的平衡常数K值减小
难度: 困难查看答案及解析
-
t℃时,将0.200 mol/L的某一元酸HA与0.200 mol/L的NaOH溶液等体积混合,所得混合溶液中部分离子浓度如下表。下列说法中错误的是( )
微粒
H+
Na+
A-
浓度(mol/L)
2.50×10-10
0.100
9.92×10-2
A. HA是弱酸
B. 混合溶液中c(HA)=0.08×10-2 mol/L
C. t℃时,一元酸HA的电离常数K=3.10×10-8
D. 混合溶液中:c(Na+)>c(A-)>c(HA)>c(OH-)
难度: 困难查看答案及解析
-
氮的固定对工农业及人类生存具有重大意义。
合成氨是最重要的人工固氮:N2(g)+3H2(g)
2NH3(g) △H<0。
(1)下列关于该反应的说法中,正确的是___________(填正确选项字母编号)。
A.反应达到平衡状态时,N2、H2、NH3的体积比为1∶3∶2
B.加催化剂可以加快正反应速率,减慢逆反应速率
C.高温既有利于加快反应速率也有利于提高氨气的产率
D.高压既有利于加快反应速率也有利于提高氨气的产率
(2)一定温度下,在容积为1L的密闭容器中,加入lmolN2和3mol H2,反应达到平衡时H2的转化率为60%,此时反应消耗N2物质的量为___________mol;保持容器体积不变,再向容器中加入1molN2,3mol H2,反应再次达到平衡时,氢气的转化率将___________(填“增大”或“减小”或“不变”)。
(3)标准状况下,将22.4 mL的氨气通入100 mL 0.01 mol·L-1的盐酸中,充分反应后,溶液中各离子浓度由大到小的顺序是________________________。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学反应方程式为____________________。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递 H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如图所示,写出阴极的电极反应式____________________。
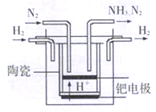
难度: 困难查看答案及解析




