-
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
A、1:1 B、1:4 C、4:1 D、1:2
难度: 中等查看答案及解析
-
下列反应的离子方程式书写中,正确的是( )
A.硫酸与氢氧化钡在溶液中反应:Ba2++SO42﹣═BaSO4↓
B.用Cl2将苦卤中的Br﹣氧化:Cl2+Br﹣═Cl﹣+Br2
C.用小苏打治疗胃酸过多:HCO3﹣+H+═CO2↑+H2O
D.用FeCl3溶液腐蚀铜箔制造印刷电路板:Fe3++Cu═Fe2++Cu2+
难度: 中等查看答案及解析
-
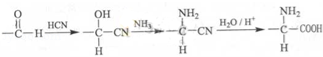
根据CH2=CHCH2COOH的结构,它不可能发生的反应是( )
A.与乙醇在浓硫酸催化下发生酯化反应
B.使溴的四氯化碳溶液褪色
C.与银氨溶液反应析出银
D.与新制氢氧化铜反应
难度: 中等查看答案及解析
-
在实验探究课上,同学们积极思考,涉及以下实验方案用以验证浓硫酸的吸水性,其中在理论上可行的方案有几种( )
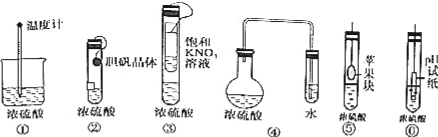
A.3种 B.4种
C.5种 D.6种
难度: 中等查看答案及解析
-
A、B、C、D、E是五种原子序数依次增大的短周期元素,B与C在放电条件下可生成无色气体,D与E可形成离子化合物,A、B形成的某种气体与A、E形成的气体相遇会产生白烟,B、D最外层电子数之和与E的最外层电子数相等.下列说法正确的是( )
A. B与C只能形成一种化合物
B. A、C形成的某种化合物不可能与A、E形成的化合物电子总数相同
C. A、C、E三种元素形成的化合物一定是弱酸
D. 工业上单质D可用海水为原料制备
难度: 中等查看答案及解析
-
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一.对下列反应的推断或解释正确的是( )
选项
操作
可能的实验现象
解释
A
某溶液中加入硝酸酸化的氯化钡溶液
有白色沉淀生成
溶液中一定含有SO42﹣
B
向淀粉KI溶液中不断通入C12
溶液变蓝后褪色
C12先表现氧化性后表现漂白性
C
CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液
溶液不显红色
黑色固体没有Fe3O4
D
将SO2通入BaCl2溶液中
没有白色沉淀生成
BaSO3可溶于酸
难度: 中等查看答案及解析
-
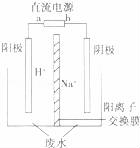
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为Na2S4+3NaBr
2Na2S2+NaBr3.闭合开关K时,b极附近先变红色.下列说法正确的是( )
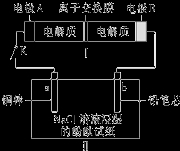
A.负极反应为4Na﹣4e﹣═4Na+
B.闭合K后,b电极附近的pH变小
C.闭合K后,a电极上有气体产生
D.当有0.01mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112mL
难度: 中等查看答案及解析