-
某学生将一氯丙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果未见到白色沉淀生成,其主要原因是( )
A、加热时间太短 B、不应冷却后再滴入AgNO3溶液
C、加AgNO3溶液后未加稀HNO3 D、加AgNO3溶液前未用稀HNO3酸化
难度: 中等查看答案及解析
-
下列有机化合物的命名正确的是( )
A. 2,3,3-三甲基丁烷 B. 2-甲基-3-丁烯
C. 2-甲基-2,4-己二烯 D. 2-乙基戊烷
难度: 困难查看答案及解析
-
下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、淀粉
②含有氧元素的化合物叫氧化物
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物
④同素异形体:C60、C70、金刚石、石墨
⑤强电解质溶液的导电能力一定强
⑥在熔化状态下能导电的化合物为离子化合物
⑦有单质参加的反应或有单质生成的反应是氧化还原反应
A. 全部正确 B. ①②⑤⑦ C. ②③⑥ D. ④⑥
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色透明的溶液: H+、Al3+、NH4+、NO3-、K+
B.FeCl3溶液中:K+、Na+、SCN-、Cl-
C.能使淀粉KI试纸显蓝色的溶液中:K+、SO42-、S2-、SO32-
D.含有0.1 mol·L-1 HCO3-的溶液:Na+、Fe3+、NO3-、SO42-
难度: 中等查看答案及解析
-
下列化合物的核磁共振氢谱中出现三组峰的是( )
A. 2,5-二甲基己烷 B. 2-甲基-2-丁醇
C. 甲苯 D. 氯乙烷
难度: 简单查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法正确的是
A. 含lmolH2SO4的浓硫酸与足量铜在加热条件下反应,转移的电子总数为NA
B. 0.1 L0.5mol/LCH3COOH 溶液中含有的氢离子为0.05NA
C. 粗铜精炼时阳极质量减少6.4g,则外电路上通过0.2NA电子
D. 1molCH3COONa和少量CH3COOH溶于水所得到的中性溶液中,CH3COO-的数目为NA
难度: 中等查看答案及解析
-
检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是( )
A. NaOH B. KMnO4 C. KSCN D. 苯酚
难度: 中等查看答案及解析
-
1.01×105Pa、120℃时,某气态烃在密闭容器中与过量O2混和点燃,完全反应后,保持温度、压强不变,体积减小的是( )
A. CH4 B. C2H6 C. C3H4 D. C3H3
难度: 简单查看答案及解析
-
下列反应中前者属于取代反应,后者属于加成反应的是( )
A. 乙醇与金属Na反应;乙烯使酸性高锰酸钾溶液的褪色
B. 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷
C. 苯滴入浓硝酸和浓硫酸的混合液中,有油状液体生成;乙烯与水生成乙醇的反应
D. 在乙醛中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应
难度: 简单查看答案及解析
-
下图是一种重要的有机合成原料。下列有关说法中正确的是( )
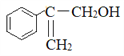
A. 该有机物的分子式为C9H12O
B. 在一定条件下,该有机物可以与HBr发生取代反应
C. 1mol该有机物可与4molBr2发生加成反应
D. 该有机物有三种官能团
难度: 简单查看答案及解析
-
利用海水提取溴和镁的一般过程如下,下列说法正确的是( )
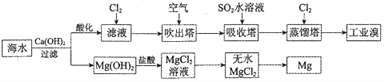
A. 工业溴中含少量Cl2,可用NaOH溶液除去
B. 工业上常利用电解MgCl2溶液冶炼金属镁
C. 富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D. 若提取1molBr2,至少需要44.8L的Cl2
难度: 中等查看答案及解析
-
下列有关物质的应用与性质相对应的说法正确的有( )
①明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有吸附性
②氯化铁溶液可用于腐蚀印刷电路板是因为其能氧化单质铜
③MgO、Al2O3的熔点很高,可制作耐高温材料
④NaHCO3能与碱反应,因此食品工业上可用作焙制糕点的膨松剂
⑤H2O2、SO2都能使酸性KMnO4褪色,是因为H2O2具有还原性,SO2具有漂白性
A. 2个 B. 3个 C. 4个 D. 5个
难度: 简单查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
操 作
可能的现象
结 论
A
向某溶液中先滴加少量氯水,再滴加KSCN溶液
溶液变为红色
溶液中一定含有Fe2+
B
向酚酞溶液中加入过量的Na2O2
溶液先变红后褪色
Na2O2与水生成的碱有漂白性
C
将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰
黑色的铜丝变红
CuO被内焰中的乙醇蒸气还原
D
向饱和 Na2CO3溶液中通入CO2
有晶体析出
溶解度:NaHCO3﹥Na2CO3
难度: 困难查看答案及解析
-
某同学利用下列实验探究金属铝与铜盐溶液的反应:
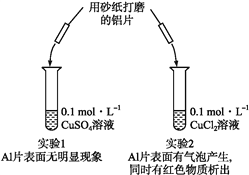
下列说法正确的是( )
A. 由实验1可以得出结论:金属铝的活泼性弱于金属铜
B. 实验2中生成红色物质的离子方程式为Al+Cu2+
Al3++Cu
C. 溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
D. 由上述实验可推知:用砂纸打磨后的铝片分别与H+浓度均为0.2 mol·L-1的盐酸和硫酸溶液反应,后者更剧烈
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.
和
互为同素异形体 B. 红磷和白磷互为同位素
C. 邻二甲苯和对二乙苯互为同系物 D. CH3C(CH3)2CH3和
互为同分异构体
难度: 简单查看答案及解析
-
下列物质中,既能发生消去反应生成烯烃,又能发生氧化反应生成醛的是( )
A. CH3OH B.
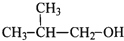
C.
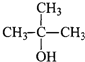 D.
D. 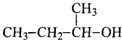
难度: 中等查看答案及解析
-
实验废液中可能含有离子K+、Mg2+、Cl-、Ba2+、SO42-、CO32-中的几种,为确定可能含有的离子,兴趣小组进行了下面的实验:①取一份废液,加入氯化钡溶液有白色沉淀产生,再加入足量稀盐酸,沉淀无变化;②另取一份废液,加入氢氧化钾溶液出现白色沉淀,再加入足量稀盐酸,沉淀全部溶解,分析上面实验得出的结论中,正确的是( )
A. 只含有Mg2+、SO42-
B. 一定含有K+、Mg2+、Cl-、SO42-
C. 一定含有Mg2+、SO42-,可能含有Cl-、K+
D. 一定含有Cl﹣、K+,可能含有Mg2+、SO42-
难度: 中等查看答案及解析
-
有关如下所示化合物的说法不正确的是( )
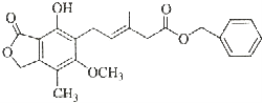
A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3mol NaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
难度: 中等查看答案及解析
-
A、B、C三种醇分别与足量的金属钠反应产生相同体积的氢气,消耗这三种醇的物质的量之比是3∶6∶2,则A、B、C这三种醇分子中羟基的个数比是( )
A. 3∶2∶1 B. 2∶6∶3
C. 3∶6∶2 D. 2∶1∶3
难度: 简单查看答案及解析
-
下列有关除杂质(括号中为杂质)的操作中,肯定错误的是( )
A. 乙烷(乙烯):通过盛有足量溴水的洗气瓶
B. 溴乙烷(乙醇):多次加水振荡,分液,弃水层
C. 苯(苯酚):加足量浓溴水,振荡,过滤除去
D. 溴苯(溴):加稀氢氧化钠溶液充分振荡洗涤后分液
难度: 中等查看答案及解析
-
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A. 能使pH试纸显蓝色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存
B. 向溴水中加入足量氯化亚铁溶液能使溴水变成无色
C. 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32-
D. 向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-
难度: 中等查看答案及解析

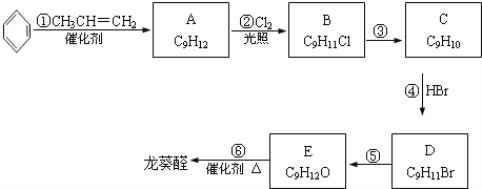
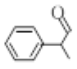 )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):