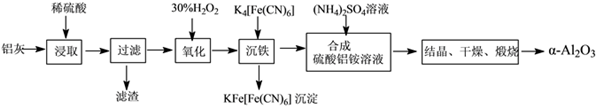-
以赤铁矿(主要成分为60.0%Fe2O3,杂质有3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:
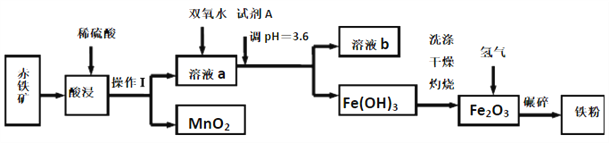
已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示, 请回答下列问题:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 3.4 | 5.2 | 9.7 | 6.7 |
(1)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____________________________。
(2)将pH控制在3.6的目的是_______。 已知25℃时,Ksp[Cu(OH)2]=2×10-20 ,该温度下反应Cu2++2H2O Cu(OH)2+2H+的平衡常数K=_______。
Cu(OH)2+2H+的平衡常数K=_______。
(3)加入双氧水时反应的离子方程式为_______。
(4)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1Kg,写出该反应完整的化学方程式:_______________。
-
以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3等杂质)为原料制备金属铬的工艺流程如图所示:
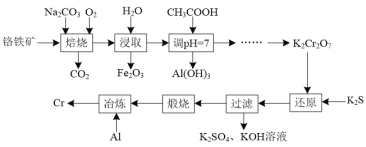
(1)“焙烧”后所得固体为Na2CrO4、Fe2O3和NaAlO2。
①“焙烧”时FeO·Cr2O3发生反应的化学方程式为____。
②“焙烧”时Al2O3发生反应的化学方程式为____。
(2)“调pH=7”时生成Al(OH)3的离子方程式为____。
(3)“过滤”所得滤渣为Cr(OH)3,“还原”反应的离子方程式为____。
(4)“冶炼”时的化学方程式为____。
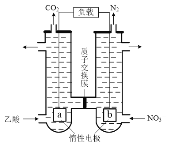
(5)含醋酸的酸性废水可用图2所示方法处理,写出负极的电极反应式:____。
-
纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
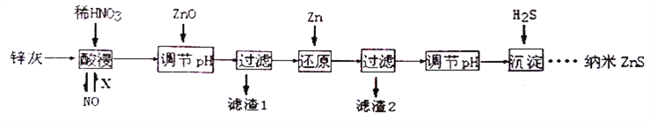
请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式_______________________。
(2)将酸浸的尾气循环利用,加入的X气体可以是____________________________。
(3)流程中加入ZnO调pH的目的是__________________________________________。
(4)滤渣2中的成分是___________________。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol/L,则溶液中S2-浓度大于______mol/L,才生成ZnS沉淀。
-
以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
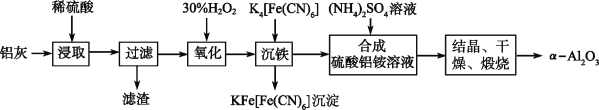
(1)写出铝灰与硫酸反应涉及的离子方程式________________________________________________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为______________________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
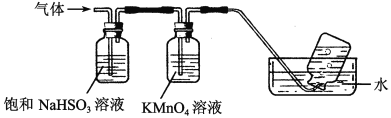
①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO4—被还原为Mn2+),发生的离子反应方程式为_________________。
-
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
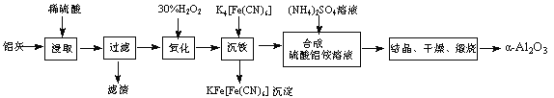
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
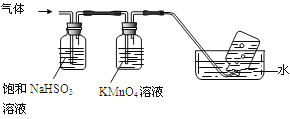
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
-
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
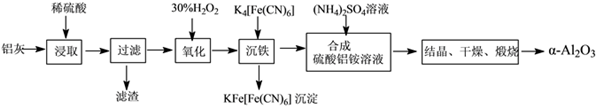
(1)铝灰中氧化铝与硫酸反应的化学方程式为____________________________________。
(2)加30%的H2O2溶液的目的是_________________________________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]  2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体为___________(填化学式)。
②KMnO4溶液褪色(MnO4-还原为Mn2+),此褪色过程中,氧化剂与还原剂的物质的量之比为_______________。
-
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
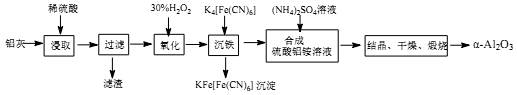
(1)铝灰中氧化铝与硫酸反应的化学方程式为_____________________;
(2)加30%的H2O2溶液的目的是_____________________;
(3)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2•12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如下图所示的装置。
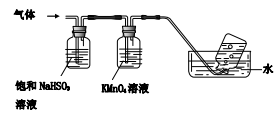
①集气瓶中收集到的气体是________(填化学式);
③KMnO4溶液褪色(MnO4-还原为Mn2+),此褪色过程中,氧化剂与还原剂的物质的量之比为________。
-
以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
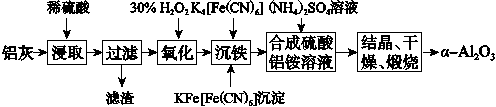
(1)铝灰中氧化铝与硫酸反应的化学方程式为__________________________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30% H2O2溶液发生反应的离子方程式为_________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为
4[NH4Al(SO4)2·12H2O]2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生反应的离子方程式为______________。
-
(10分)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3 等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
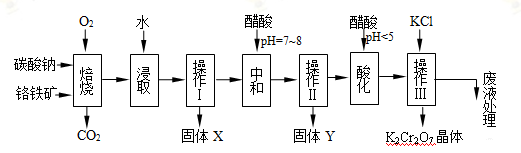
已知:①4FeO•Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3  2NaAlO2 +CO2↑;
2NaAlO2 +CO2↑;
③Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是 _。
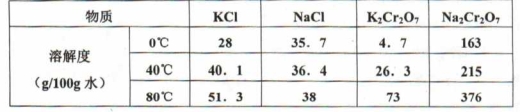
(2)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr207 + 2KCl=K2Cr207 ↓+ 2NaCl,该反应在溶液中能发生的理由是 _
(3)操作III有多步组成,获得K2Cr207晶体的操作依次是:加入KC1固体、蒸发浓缩、 _、过滤、 _、干燥。
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量 _ (填写试剂)、溶解、过滤、再通入足量 _气体.......灼烧、冷却、称量,得干燥固体m g。计算祥品中氢氧化铝的质量分数为 _ (用含m、n的代数式表示)。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min。然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2SO3标准溶液滴定若实验中共用去Na2S203标准溶液47.40mL,则所得产品中重铬酸钾的纯度为 _。(保留3位有效数字)
已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-
-
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
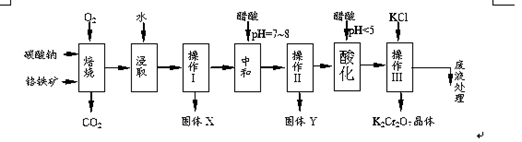
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、________、过滤、_______、干燥。
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl → K2Cr2O7↓+2NaCl。
| 物质 | 溶解度/(g/100g水) |
| 0°C | 40°C | 80°C |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
该反应在溶液中能发生的理由是_______________。
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_________(用含m、n的代数式表示)。

Cu(OH)2+2H+的平衡常数K=_______。