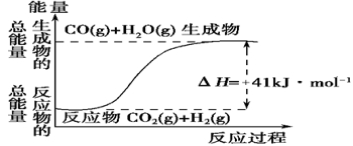
-
下列说法中正确的是
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化源
B.同温同压下,H2(g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H相同
C.生成物的总焓大于反应物的总焓时,反应放热,ΔH<0
D.ΔH的大小与热化学方程式的化学计量数无关
难度: 简单查看答案及解析
-
下列反应中,生成物的总能量大于反应物总能量的是
A.焦炭在高温下与水蒸气反应
B.锌和稀硫酸反应制取氢气
C.盐酸和氢氧化钠的中和反应
D.氢气在氧气中燃烧
难度: 简单查看答案及解析
-
C(s)+CO2(g)
2CO(g)反应中,可使反应速率增大的措施是
①增大压强 ②升高温度 ③通入CO2 ④增大C的量 ⑤减小压强
A.①②③ B.①②③④ C.②③④ D.②③④⑤
难度: 中等查看答案及解析
-
已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-87
0.3 kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+
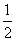 O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
O2(g)=H2O(l) ΔH3=-285.8 kJ/mol则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A.-870.3 kJ/mol B.-571.6 kJ/mol
C.+787.0 kJ/mol D.-488.3 kJ/mol
难度: 困难查看答案及解析
-
已知有:
(l)H2(g)+
 O2(g)=H2O(g);△H1=akJ·
O2(g)=H2O(g);△H1=akJ·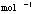
(2)H2(g)+O2(g)=2H2O(g);△H2=bkJ·
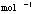
(3)H2(g)+
 O2(g)=H2O(l);△H3=ckJ·
O2(g)=H2O(l);△H3=ckJ·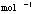
(4)H2(g)+O2(g)=2H2O(l);△H4=dkJ·
下列关系式中正确的是
A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
难度: 中等查看答案及解析
-
在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)
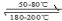 Ni(CO)4(g),△
Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,△H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
难度: 中等查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是
A.1molN2(g)和1molO2(g)完全反应放出的能量为180kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
难度: 中等查看答案及解析
-
一定量的盐酸跟过量铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
A.NaOH(固体) B.冰醋
酸 C.HCl D.CH3COONa(固体)
难度: 中等查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2
难度: 中等查看答案及解析
-
298K下,将1mol蔗糖溶解在1L水中,此溶解过程中体系的∆G = ∆H-T∆S和∆S的变化情况是
A.∆G>0,∆S<0 B.∆G<0,∆S>0 C.∆G>0,∆S>0 D.∆G<0,∆S<0
难度: 中等查看答案及解析
-
某反应过程能量变化如图所示,下列说法正确的是
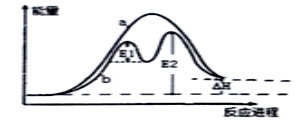
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于△H
C.使用催化剂,可改变该反应的活化能
D.有催化剂的条件下,反应的活化能等于 E1+E2
难度: 中等查看答案及解析
-
100℃时,将0.1molN2O4置于1L密闭容器中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
A.N2O4的消耗速率与NO2的生成速率之比为1:2
B.烧瓶内气体的颜色不再加深
C.烧瓶内气体的平均相对分子质量不再变化
D.烧瓶内气体的压强不再变化
难度: 中等查看答案及解析
-
可逆反应A(g)+3B(g)
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是
A.VA=0.15mol•(L•min)﹣1 B.VB=0.6 mol•(L•
min)﹣1
C.VC=0.4 mol•(L•min)﹣1 D.VD=0.01 mol•(L•s)﹣1
难度: 中等查看答案及解析
-
密闭容器中,反应xA(g)+yB(g)
zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是
A.x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
难度: 中等查看答案及解析
-
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热是110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ
/mol
D.稀盐酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
难度: 中等查看答案及解析
-
在一密闭容器中进行反应:X2(g)+Y2(g)
2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是
A.Z的浓度可能为0.3mol/L
B.平衡时X2、Y2的转化率相等
C.平衡时,Y2和Z的生成速率之比为2:1
D.若平衡后再改变外界条件,升高温度,则反应的平衡常数
将变大
难度: 中等查看答案及解析
-
已知2SO2(g)+O2(g)
2SO3(g) △H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙>2P乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
难度: 困难查看答案及解析