-
(10分)(1)①根据图示,写出反应的热化学方程式:________。

②根据如图所示情况,判断下列说法中正确的是( )

A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ/mol
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41 kJ/mol
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________。
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:________。

a、b两条曲线产生区别的原因很可能是________。
-
Ⅰ.(1)根据如图所示情况,判断下列说法中正确的是 。
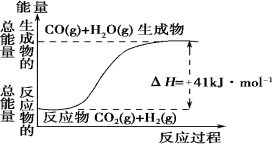
A.其热化学方程式为:CO(g) + H2O(g)=CO2(g) + H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为 (用含△H1 、△H2、△H3的式子表示)。
、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为 。
②已知反应2HI(g) H2(g) + I2(g)的△H= + 11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g) + I2(g)的△H= + 11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
③Bodensteins研究了下列反应:2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 |  0.773 0.773
| 0.780 | 0.784 |
根据上述实验结果,该反应的平衡常数K的计算式为: 。上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k 逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
-
I.(1)根据如图所示情况,判断下列说法中正确的是 。
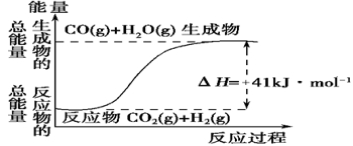
A.其热化学方程式为:CO(g)+ H2O(g)=CO2(g) + H2(g) ΔH=+41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g)=2NO(g) △H1
2H2(g)+ O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H4 的反应焓变为 (用含△H1 、△H2、△H3的式子表示)。
、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:已知反应2HI(g)  H2(g)+I2(g) 的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g)+I2(g) 的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
-
I.(1)根据如图所示情况,判断下列说法中正确的是 。
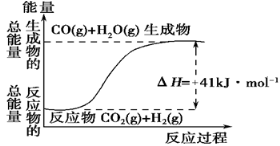
A.其热化学方程式为:CO(g)+ H2O(g)=CO2(g) + H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g)=2NO(g) △H1
2H2(g)+ O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H4 的反应焓变为 (用含△H1 、△H2、△H3的式子表示)。
、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的离子方程式为 。
②已知反应2HI(g)  H2(g)+I2(g) 的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g)+I2(g) 的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
-
(1)根据如图所示情况,判断下列说法中正确的是 。

A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,该反应的热化学方程式是 。
(3)已知反应: N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
-
(1)根据如图所示情况,判断下列说法中正确的是 。

A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,该反应的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
-
(1)根据如图所示情况,判断下列说法中正确的是________。
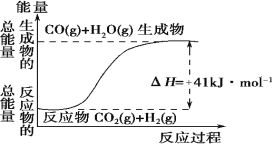
A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是_________。
(3)已知反应:N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为________________(用含△H1、△H2、△H3的式子表示)。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为__________________。
-
(8分)(1)根据如图所示情况,判断下列说法中正确的是______________。

A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值大于41 kJ·mol-1
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________。
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图

该反应的热化学方程式为__________,a、 b两条曲线产生区别的原因很可能是_____________。
-
(1)①根据图1所示,写出反应的热化学方程式______________________________。

②根据图2所示情况,判断下列说法中正确的是( )
A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+41kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是___________________。
(3)图3是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:______________________________。a、b两条曲线分别代表由N2、H2合成氨的两个不同反应过程,其反应热△Ha ___△Hb(填“>”或“<”或“=”)。
-
根据如图所示示意图,下列说法不正确的是( )

A.反应的热化学方程式可表示为C(s)+H2O(g)=CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.amol C和amol H2O(l)反应生成amol CO和a mol H2吸收的热量一定为131.3a kJ
D.1mol C、2mol H、1mol O转变成1mol CO(g)和1mol H2(g)放出的热量为a kJ

、△H2、△H3的式子表示)。
H2(g)+I2(g) 的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。











