-
下列燃料中,不属于化石燃料的是
A.煤 B.石油 C.天然气 D.水煤气
难度: 简单查看答案及解析
-
下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很易发生
C.一个反应是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定,而不是由反应是否需要加热而决定
D.吸热反应发生过程中要不断从外界获得能量、放热反应发生过程中不再需要外界能量
难度: 中等查看答案及解析
-
下列属于吸热反应的是
A.铝与盐酸反应 B.Ba(OH)2・8H2O和NH4Cl固体反应
C.盐酸和氢氧化钠的中和反应 D.氢气的燃烧反应
难度: 简单查看答案及解析
-
已知C(s,石墨)=C(s,金刚石)ΔH >0,下列判断正确的是
A、此反应为放热反应
B、断裂1 mol石墨的化学键需要吸收的能量小于生成1 mol金刚石化学键所放出的能量
C、石墨比金刚石稳定
D、此变化为物理变化
难度: 简单查看答案及解析
-
下列各组物质的燃烧热相等的是
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素
难度: 简单查看答案及解析
-
下列关于燃烧热的说法中正确的是
A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.常温下,可燃物燃烧放出的热量
C.在25℃、1.01×105Pa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学方程式前的化学计量数的改变而改变
难度: 中等查看答案及解析
-
以下几个热化学方程式,表示碳或氢气燃烧热的热化学方程式是
A.C(s)+O2(g)===CO(g) ΔH= 110.5 kJ/mol
B.C(s)+O2(g)===CO2(g) ΔH= -393.5 kJ/mol
C.2H2(g)+O2(g)===2 H2O(l) ΔH= -571.6 kJ/mol
D.H2(g)+O2(g)=== H2O(g) ΔH= -241.8 kJ/mol
难度: 简单查看答案及解析
-
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下
列热化学方程式正确的是
A.H2 O(g)= H2(g)+1/2O2(g) ΔH = 242 kJ/mol
B.2H2(g)+O2(g)= 2H2O(g) ΔH = -484 kJ/mol
C.H2(g)+1/2O2(g)= H2O(1) ΔH =-242 kJ・mol
D.2H2(g)+O2(g)= 2H2O(g) ΔH= +484 kJ・mol-1
难度: 简单查看答案及解析
-
在同温同压下,下列各组热化学方程式中Q2> Q1的是
A.H2(g)+Cl2(g)=2HCl(g) △H= -Q1;
1/2H2(g)+1/2Cl2(g)=HCl(g) △H= -Q2
B.C(s)+1/2O2(g)=CO (g) △H= -Q1;
C(s)+ O2(g)=CO2(g) △H= -Q2
C.2H2(g)+O2(g)=2H2O(l) △H= -Q1;
2H2(g)+O2(g)=2H2O(g) △H= -Q2
D.S(g)+O2(g)=SO2(g) △H= -Q1;
S(s)+O2(g)=SO2(g) △H= -Q2
难度: 中等查看答案及解析
-
已知:Zn(s)+ 1/2 O2(g)= ZnO(s) △H1= ―351.1kJ/mol
Hg(l)+ 1/2 O2(g)= HgO(s) △H2= ―90.7kJ/mol
则反应Zn(s)+HgO(s)= ZnO(s)+Hg(l)的焓变是
A.―441.8 kJ/mol B.―254.6 kJ/mol
C.―438.9 kJ/mol D.―260.4 kJ/mol
难度: 中等查看答案及解析
-
已知:CH4(g)+2O2(g)==CO2(g)+2H2O (l) △H= ―Q1KJ・mol-1
2H2(g)+O2(g)==2H2O(g) △H = ―Q2KJ・mol-1
2H2(g)+O2(g)==2H2O(l) △H = ―Q3KJ・mol-1
常温下,取体积比为4 :1的甲烷和氢气的混合气体11 .2L(标准状况),经完全燃烧后恢复到到常温,放出的热量(单位:KJ)为
A.0.4Q1+0.05Q3 B.0.4Q1+0.05Q2
C.0.4Q1+0.1Q3 D.0.4Q1+0.2Q3
难度: 中等查看答案及解析
-
已知H2(g)+ Cl2(g) === 2HCl(g) △H= -184.6KJ・mol-1,则HCl(g)==1/2H2(g)+1/2Cl2(g)的△H为
A.+184.6KJ・mol-1 B.92.3KJ・mol-1
C.-369.2KJ・mol-1 D.+92.3KJ・mol-1
难度: 简单查看答案及解析
-
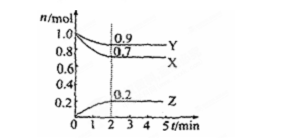
在密闭容器中A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)表示。已知υ(A)、υ(B)、υ(C)之间有以下关系2υ(B)==3υ(A),3υ(C)==2υ(B)。则此反应可表示为
A.2A+3B==2C B.A+3B== 2C
C.3A+B==2C D.A+B==C
难度: 中等查看答案及解析
-
铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是
A.0.02 mol/(L・min) B.1.8mol/(L・min)
C.1.2 mol/(L・min) D.0.18 mol/(L・min)
难度: 中等查看答案及解析
-
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是
A.①④ B.③④ C.①②③ D.②③
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体在 2 L容器中混合并在一定条件下发生如下反应:2A(g)+B(g)= 2C (g)若经2 s后测得C的浓度为0.6 mol•L-1,现有下列几种说法,其中正确的是
①用物质A表示的反应的平均速率为0.3 mol•L-1•S-1
②用物质B表示的反应的平均速率为0.6 mol•L-1•S-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol•L-1
A.①③ B.①④ C.②③ D.③④
难度: 困难查看答案及解析
-
下列各图中,表示正反应是吸热反应的图是
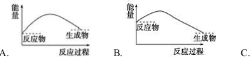
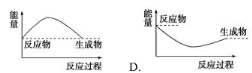
难度: 中等查看答案及解析
-
已知反应X+Y==M+N为放热反应,对该反应的下列说法中正确的
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
热化学方程式C(s)+H2O(g)= CO(g)+H2(g);△H =+131.3kJ/mol表示
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=HO(l);△H=-57.3kJ/mol,向1L0.5mol・L-1 的NaOH溶液中加入下列物质:①稀醋酸;②浓H2SO4;③稀硝酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是
A.△H1>△H2>△H3
B.△H1<△H3<△H2
C.△H1=△H3>△H2
D.△H1>△H3>△H2
难度: 中等查看答案及解析
-
对于反应2SO2(g)+O2(g)
2SO3(g) ΔH<0,能增大反应速率的措施是
A.通入大量O2 B.减小体系压强
C.移去部分SO3 D.降低体系温度
难度: 简单查看答案及解析
-
在氢气和氧气的燃烧反应2H2+ O2= 2H2O中,破坏1molH2的化学键吸收的能量为A,破坏1molO2的化学键吸收的能量为B,形成1molH2O的化学键放出的能量为C,则下列关系正确的
A.A+B>C B.A+B<C
C.2A+B>2C D.2A+B<2C
难度: 中等查看答案及解析