-
化学与生产、生活联系密切,下列说法正确的是
A.常用作净水剂的KAl(SO4)2和漂白粉都是强电解质
B.维生素C具有还原性,在人体内起抗氧化作用
C.对“地沟油”进行分馏可以获得汽油发动机的燃料
D.碘是人体必需的微量元素,所以要多吃富含高碘酸的食物
难度: 中等查看答案及解析
-
下列有关叙述正确的是
A.非金属氧化物一定为酸性氧化物
B.
和
互为同位素,化学性质相似
C.根据是否能产生丁达尔效应,将分散系分为溶液、浊液和胶体
D.已知红磷比白磷稳定,则4P(红磷,s)=P4(白磷,s) △H<0
难度: 中等查看答案及解析
-
下列有关实验的叙述正确的是
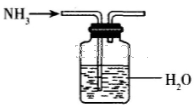
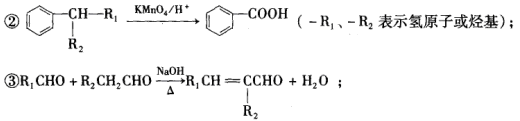
A.金属钠着火时,立即用沾水的毛巾覆盖
B.实验室可用右图所示装置制取饱和氨水
C.硅酸钠溶液保存在带橡胶塞的细口瓶中
D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
难度: 中等查看答案及解析
-
下列有关元素化合物的性质叙述正确的是
A.SO2、NO2都能与水反应,其反应原理相同
B.Na2O2在空气中长期放置最终变为NaHCO3粉末
C.既能与酸反应;又能与碱反应的物质都是两性化合物
D.可用KSCN溶液检验FeSO4溶液是否氧化变质
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示,下列说法错误的是
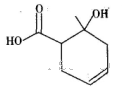
A.与乙酸互为同系物
B.含有两种含氧官能团
C.可使溴的四氯化碳溶液褪色
D.既可以发生取代反应又可以发生加成反应
难度: 中等查看答案及解析
-
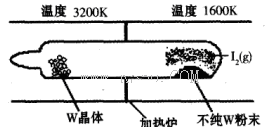
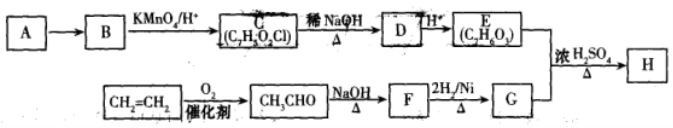
制备食用碘盐(KIO3)原理之一为:I2+2KClO3
Cl2+2KIO3,下列说法正确的是
A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀
B.反应过程中I2置换出Cl2,由此可推断非金属性I>CI
C.KClO3和KIO3均属于离子化合物,都只含有离子键
D.制备KIO3的反应中氯元素被还原
难度: 中等查看答案及解析
-
下列说法正确的是
A.N和As属于第VA族元素,N原子得电子能力比As原子强
B.族序数等于其周期序数的元素一定是金属元素
C.元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素
D.Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
难度: 中等查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是
选项 实验操作 现象 解释或结论
A 常温下铜片插入浓硫酸中 无明显现象 常温下铜浓硫酸钝化
B 将水蒸气通过灼热的铁粉 铁粉变成红棕色粉末 铁粉与水在高温下发生反应
C 将SO2通入滴有酚酞的NaOH溶液中 溶液红色褪去 SO2具有漂白性
D 向某溶液中先加入稀盐酸,后加入氯化钡溶液 先加稀盐酸无明显现象,后加氯化钡溶液有白色沉淀生成 溶液中存在SO42-
难度: 中等查看答案及解析
-
下列事实能说明亚硫酸的酸性强于碳酸的是
A.饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH
B.亚硫酸能使酸性高锰酸钾溶液褪色,而碳酸不能
C.同温下,等浓度的亚硫酸氢钠和碳酸氢钠溶液,碳酸氢钠溶液的碱性强
D.将过量二氧化硫气体通入碳酸氢钠溶液中,逸出的气体能使澄清石灰水变浑浊
难度: 中等查看答案及解析
-
在密闭容器中充入一定量的NO2,发生反应2NO2(g)
N2O4(g) △H=-57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如下图所示。下列说法正确的是
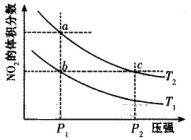
A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
难度: 中等查看答案及解析
-
下列说法错误的是
A.除去MgCl2溶液中少量的FeCl3,可选用MgCO3
B.稀硫酸中加入Zn粉,随着反应的进行,溶液中水的电离程度逐渐增大
C.能溶解氧化铝的溶液中可能大量存在:HCO3-、SO42-、NO3-、Na+
D.等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中NH4+浓度前者大于后者
难度: 中等查看答案及解析
-
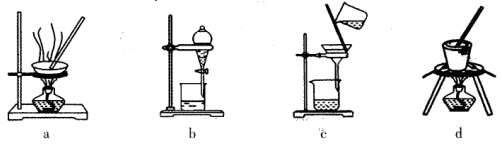
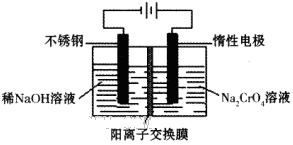
下列有关电化学装置的说法正确的是
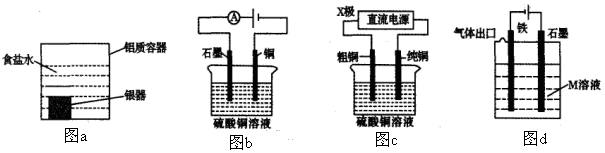
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
难度: 中等查看答案及解析
-
下列有关含铜化合物的说法错误的是(设NA为阿伏加德罗常数的值)
A.用盐酸可以洗去铜表面的铜锈
B.0.1mol/L的CuSO4溶液中,Cu2+的数目一定小于0.1NA
C.在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明Ksp(CuS)远小于Ksp(FeS)
难度: 中等查看答案及解析
-
某温度下,向一定体积0.1 mol/L的氨水中逐滴滴加0.1mol/L的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)]的变化关系如图所示,则下列说法中错误的是

A.M点所示溶液中c( NH4+)>c(Cl-)
B.Q点所示溶液的导电熊力强于M点
C.Q点消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的电离程度相同
难度: 中等查看答案及解析