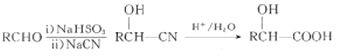
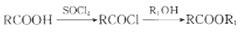-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 1mol/LAlCl3溶液中含Al3+数目一定小于NA
B. 1mol环己烷含非极性键的数目为5NA
C. 71gCl2完全反应转移电子数一定为2NA
D. 30g葡萄糖和乳酸(C3H6O3)的混合物中含氢原子数目为2NA
难度: 中等查看答案及解析
-
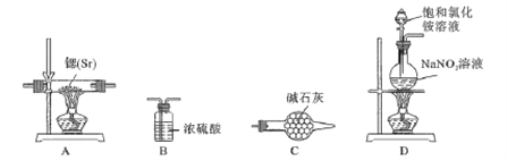
《本草纲目》中对碱式碳酸铅制备过程有如下叙述:“每铅百斤,熔化,削成薄片,卷作筒,安木甑内。甑下甑中各安醋一瓶,外以盐泥固济,纸封甑缝。风炉安火四周,养一七,便扫入水缸内。依旧封养,次次如此,铅尽为度。”文中涉及的操作方法是
A. 过滤 B. 升华 C. 蒸馏 D. 萃取
难度: 中等查看答案及解析
-
已知:CH3C≡CH+CO+CH3OH
M,N+CH3OH
M+H2O.其中M的结构简式为CH2=C(CH3)COOCH3,下列说祛正确的是
A. N、M互为同系物
B. N转化为M的反应为加成反应
C. M中所有碳原子可能共面
D. N属于酯的同分异构体有3种
难度: 中等查看答案及解析
-
下列实验中,实验操作能达到实验目的的是
选项
实验操作
实验目的
A
将炽热的木炭与浓硝酸混合所得气体通入澄清石灰水中
检验碳的氧化产物为CO2
B
将饱和NH4HCO3溶液与饱和食盐水混合
探究NH4HCO3和NaHCO3溶解度相对大小
C
向某溶液中滴加BaCl2溶液和稀硝酸
检验溶液中是否含SO42-
D
向某FeCl3溶液中通入足量Cl2,充分反应
可除去FeCl2溶液中少量的FeCl3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在新型储能体系,可充电锂二氧化碳电池被称为“可呼吸电池2.0”,该电池的总反应式为:Li+CO2+O2
Li2CO3(未配平).其工作原理如下图所示(放电时产生的碳酸锂固体储存于碳纳米管中,TEGDME是一种有机溶剂)。下列说法中正确的是

A. 放电时,CO2发生还原反应
B. 若有1.12L.CO2参与反应,则有0.2mol电子发生转移
C. 放电时,Li+从右向左移动
D. 充电时,阳极反应为2Li2CO3-4e-=2CO2↑+O2↑+4Li+
难度: 困难查看答案及解析
-
X、Y、Z、W、Q为短周期中的五种元素,其中Q在同周期中的原子半径最小。下列说祛正确的是

A. 简单氢化物的热稳定性:Y>W
B. 简单离子半径:Y>Z>W>Q
C. X、Q与氢元素所形成化合物的溶液能使石蕊试纸变蓝
D. 常温下,X的最高价氧化物对应水化物的浓溶液与Z的单质反应生成有色气体
难度: 中等查看答案及解析
-
常温下,用0.01mol/L的NaOH溶液滴定某浓度的H2N2O2(二元弱酸)溶液,所得溶液中H2N2O2、HN2O2-、N2O22-三种微粒的物质的量分数(δ)与溶液PH的关系如图所示。则下列说法中正确的是

A. 该滴定过程应该选择甲基橙作为指示剂
B. Ka1(H2N2O2)的数量级为10-4.2
C. pH=1.2溶液中:c(Na+)+c(H+)=c(OH-)+c(H2N2O2)
D. pH=4.2溶液中:c(Na+)>2c(N2O22-)+c(HN2O2-)
难度: 中等查看答案及解析