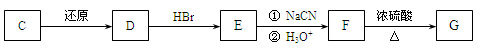
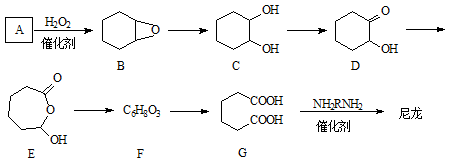
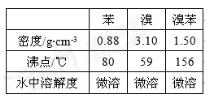
-
已知
As、
Br位于同一周期。下列关系正确的是
A.原子半径:As>Cl>P B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl- D.酸性:H3AsO4>H2SO4>H3PO4
难度: 中等查看答案及解析
-
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
A.Na B.Al C.Fe D.Cu
难度: 中等查看答案及解析
-
碘晶体升华时,下列所述内容发生改变的是
A.分子内共价键 B.分子间的作用力
C.碘分子的大小 D.分子内共价键的键长
难度: 中等查看答案及解析
-
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其化学方程式为: Cu(NH3)2Ac+CO+NH3
[Cu(NH3)3CO]Ac;若要提高上述反应的正反应速率,可采取的措施是
①增加NH3的浓度 ②降温 ③减压 ④及时移走产物
A.① B.②③ C.③④ D.①②④
难度: 中等查看答案及解析
-
在一定条件下用NH3捕获CO2可以生成重要的有机化工产品——三聚氰酸,反应的化学方程式如下:
NH3 + CO2 →
+ H2O
下列有关三聚氰酸的说法正确的是
A.分子式为C3H6N3O3 B.分子中既含极性键,又含非极性键
C.属于共价化合物 D.生成该物质的上述反应为中和反应
难度: 中等查看答案及解析
-
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作制冷剂
C.硫酸用作催化剂 D.生石灰作干燥剂
难度: 中等查看答案及解析
-
下列化合物中同分异构体数目最少的是
A.丁烷 B.丁烯 C.丁醇 D.乙酸乙酯
难度: 中等查看答案及解析
-
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
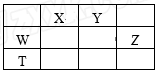
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
难度: 中等查看答案及解析
-
下列反应中,反应后体系中的固态物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
难度: 中等查看答案及解析
-
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是
A.H2 B.Ag(NH3)2OH溶液 C.HBr D.Br2的CCl4溶液
难度: 中等查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO气体的物质的量最多的是
A.FeO B.Fe2O3 C.FeSO4 D.Fe3O4
难度: 简单查看答案及解析
-
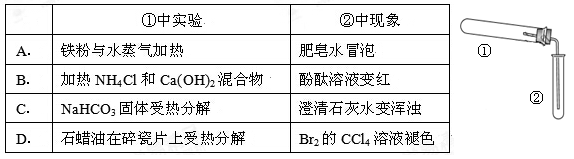
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是
难度: 中等查看答案及解析
-
2-丁炔与1,3-丁二烯分别跟氢气反应的热化学方程式如下: CH3—C≡C—CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+Q1 ;CH2=CH—CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+Q2
已知:Q1 > Q2(Q1和Q2均大于零),由此不能判断
A.2-丁炔与1,3-丁二烯稳定性的相对大小
B.2-丁炔与1,3-丁二烯分子储存能量的相对高低
C.2-丁炔与1,3-丁二烯相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
难度: 中等查看答案及解析
-
下列关于0.10 mol/L NaHCO3溶液的说法正确的是
A.溶质的电离方程式为:NaHCO3→Na++H++CO32-
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3- )+c(CO32-)
D.温度升高,c(HCO3- )增大
难度: 中等查看答案及解析
-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
C.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
D.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
难度: 简单查看答案及解析
-
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。滤出小苏打后,母液提取氯化铵有两种方法:
① 通入氨,冷却、加食盐,过滤 ② 不通氨,冷却、加食盐,过滤
对上述两种方法评价中错误的是
A.①析出的氯化铵纯度更高 B.①的滤液可直接循环使用
C.②析出的氯化铵纯度不高 D.②的滤液可直接循环使用
难度: 中等查看答案及解析
-
以石墨为电极,电解含有少量酚酞和淀粉的NaI溶液。已知:通常条件下,I-的放电能力比Cl-更强。下列说法错误的是
A.阴极附近溶液呈红色 B.阴极逸出气体
C.阳极附近溶液呈蓝色 D.溶液的pH变小
难度: 中等查看答案及解析
-
从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 mol甲苯含有C—H键数目为8NA
B.1 mol丙烯酸中含有双键的数目为NA
C.由a g C2H4和C3H6组成的混合物中所含共用电子对数目为3aNA/14
D.在过氧化钠跟水的反应中,每生成2.24 L氧气,转移电子的数目为0.2NA
难度: 中等查看答案及解析
-
雾霾会影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:
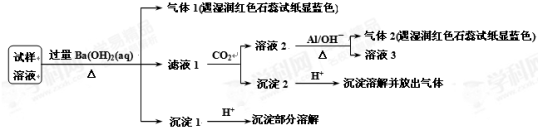
已知:3NO3-+8Al +5OH-+2H2O
3NH3↑+8AlO2-
根据以上的实验操作与现象,该同学得出的结论错误的是
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中可能存在Na+、Cl-
C.可以确定该雾霾的成分是NaNO3、NH4Cl和MgSO4
D.试样中一定不含Al3+
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸: Cu+2H++NO3- ==Cu2++NO2↑+H2O
B.在复盐NH4Fe(SO4)2溶液中加入一定量的Ba(OH)2溶液:2Fe3++3SO42-+3Ba2++6OH-==3BaSO4↓+2Fe(OH)3↓
C.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+ == CO2↑+3H2O
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O ==Al(OH)3↓+HCO3-
难度: 困难查看答案及解析
-
将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法正确的是
A.若某温度下,反应后
=11,则溶液中
=
B.参加反应的被还原的氯气为
mol
C.改变温度,反应中转移电子的物质的量ne的范围:
mol≤ne≤
mol
D.改变温度,产物中KClO3的最大理论产量为
mol
难度: 中等查看答案及解析

 )和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
)和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。