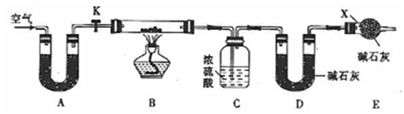
-
下列说法不正确的是
A. 化学变化一定伴随能量变化,有能量变化的过程不一定是化学变化
B. 甲烷燃烧时,化学能完全转化为热能
C. 植物燃料燃烧时放出的能量来源于太阳能
D. 旧化学键断裂所吸收的能量大于新化学键形成所放出的能量时,该反应为吸热反应
难度: 简单查看答案及解析
-
S—诱抗素是保证鲜花盛开的一种植物制剂,其分子结构如图,该分子中不含有的宫能团是
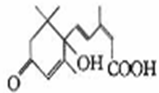
A. 碳碳双键 B. 羟基 C. 醛基 D. 羧基
难度: 简单查看答案及解析
-
最近《科学》杂志评出十大科技突破,其中“火星上‘找’到水的影子”排名笫一。下列关于水的说法中正确的是
A. 水的电离是放热的过程 B. 加入电解质一定会破坏水的电离平衡
C. 水的电离和电解都需要电 D. 水、乙酸和硫酸钡均属于电解质
难度: 中等查看答案及解析
-
下列生活中常见的过程或现象不属于化学变化的是

难度: 简单查看答案及解析
-
设NA为阿伏加徳罗常数的数值,下列叙述正确的是
A. 7.8 g苯中含有的碳碳双键数目为0.3NA
B. 1mol·L-1的FeCl3溶液中含有的Fe3+数目小于NA
C. 46 g N2O4气体中含有的原子数为3 NA
D. 用电解法精炼铜的反应中转移0.2 NA个电子时,阳极溶解6.4g铜
难度: 简单查看答案及解析
-
下列有关实验操作的叙述不正确的是
A. 可用酸式滴定管移取高锰酸钾溶液
B. 实验剩余的药品都要放回原试剂瓶中,不能随意丢弃
C. 使用经蒸馏水润湿的pH试纸测溶液的pH,结果可能偏小
D. 配制一定物质的量浓度的NaCl溶液,定容时俯视会使溶液浓度偏高
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
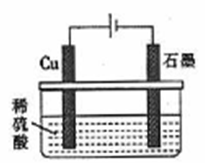
A. 碳酸的电离方程式:H2CO3
2H++CO32-
B. 碱性氢氧燃料电池负极的电极反应式:H2-2e-==2H+
C. HCO3-的水解方程式:HCO3-+H2O
CO32-+H2O+
D. 如图所示,反应开始时的离子方程式:Cu+2H+
Cu2++H2↑
难度: 中等查看答案及解析
-
某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1:1, 由此可以得出的结论是
A. 分子中C、H的原子个数之比为1:2
B. 该有机物中必定含氧
C. 分子中C、H、O的原子个数之比为1:2:1
D. 该有机物属于烃类
难度: 简单查看答案及解析
-
三氯异氰尿酸(
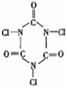 )是一种极强的氧化剂和氯化剂。以HC1O与氰尿酸(
)是一种极强的氧化剂和氯化剂。以HC1O与氰尿酸( )为原料混合氯化可制得三氯异氰尿酸。若原料完全反应,则次氯酸与氰尿酸的物质的量之比为
)为原料混合氯化可制得三氯异氰尿酸。若原料完全反应,则次氯酸与氰尿酸的物质的量之比为A. 1:3 B. 1:6 C. 3:1 D. 6:1
难度: 中等查看答案及解析
-
下列各组离子在指定条件下能大量共存的是
A. 25℃时,由水电离出的 c(H+)=l0-12mol·L-1的溶液中:Mg2+、Na+、NO3-、CH3COO-
B.
 =1012的溶液中:K+、A13+、NO3-、C1-
=1012的溶液中:K+、A13+、NO3-、C1-C. 能与铝反应放出氢气的溶液中:HCO3-、NO3- 、Fe3+、Ba2+
D. 1.0 mol·L-1的 KNO3溶液中:H+、Fe2+、C1-、SO42-
难度: 中等查看答案及解析
-
六苯乙烷为白色固体,其结构如图所示。它的一氯代物(不包括立体异构)有

A. 1种 B. 3种 C. 5种 D. 15 种
难度: 中等查看答案及解析
-
向一定体积pH=12的Ba(OH)2溶液中逐滴加人一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液和NaHSO4溶液体积之和,则Ba(OH)2溶液和NaHSO4溶液体积之比是
A. 1;9 B. 1:4 C. 1:2 D. 1:1
难度: 中等查看答案及解析
-
常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2==2CO2+3H2O,其工作原理如图所示。下列有关说法正确的是
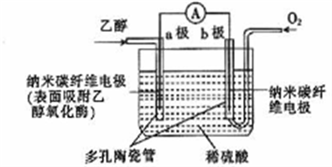
A. 乙醇发生还原反应
B. b极上的电极反应式为O2+4e-十2H2O==4OH-
C. 电池工作时,电解液中的H+由a极向b极迁移
D. 当外电路中有1.2 mol电子转移时,能产生4.48 L CO2
难度: 中等查看答案及解析
-
已知X、Y、Z三种短周期元素的族序数之和为11,且X、Y、Z能形成化合物X2YZ3。下列判断正确的是
A. X、Y、Z不可能为同周期元素
B. 化合物X2YZ3可能难溶于水
C. Y的原子半径一定比Z小
D. X可能位于第IIA族
难度: 困难查看答案及解析
-
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是

A. 该温度下,a点溶液呈碱性
B. 该温度下,0.01 mol·L-1NaOH溶液的pH等于12
C. 该温度下,加入NaOH可能引起由d向b的变化
D. b点时,升高温度,可能引起由b向c的变化
难度: 中等查看答案及解析
-
向一300 mL的恒容密闭容器中加入一种多孔粉块状物质R,并充入一定量的CO气体,一定条件下发生反应:R(s)+4CO(g)
R(CO)4(g),已知该反应平衡常数与温度的关系如下表。
温度/℃
25
80
230
平衡常数
5×104
2
1.9×10-5
下列说法不正确的是
A. 物质R做成多孔状可增大接触面积,加快化学反应速率
B. 25℃时反应R(CO)4(g)
R(s)+4CO(g)的平衡常数为 2×10-5
C. 80℃时,测得某时刻R(CO)4、CO的浓度均为0.5 mol·L-1,则此时v(正)>v(逆)
D. 80℃时反应达到平衡,测得n(CO)=0.3 mol,则R(CO)4的平衡浓度为2 mol·L-1
难度: 中等查看答案及解析