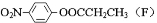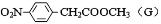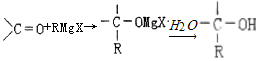-
已知同周期非金属元素X、Y的非金属性:X>Y,下列说法错误的是( )
A.X的原子序数一定大于Y B.第一电离能Y可能大于X
C.简单离子的半径:Xm-> Yn- D.气态氢化物的稳定性:HmX强于HnY
难度: 中等查看答案及解析
-
下列关于价电子构型为4s24p4的基态原子描述正确的是( )
A.它的元素名称为锡 B.它的核外电子排布式为[Ar]4s24p4
C.它的第一电离能小于As D.其外围电子排布图为
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.亚磷酸H3PO3只有Na2HPO3、NaH2PO3两种钠盐,所以亚磷酸没有正盐
B.同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强
C.配位键也有方向性和饱和性
D.H3PO4和H2CO3分子中非羟基氧的个数均为1,他们的酸性相近,均为中强酸
难度: 简单查看答案及解析
-
H2S是一种有臭鸡蛋气味的气体,其分子结构和H2O相似,但S—H键键能比O—H键键能低。下列判断错误的是( )
A.H2S分子呈V形
B.H2S沸点低于H2O沸点,因为S—H键键能低
C.H2S分子中只含σ键
D.H2S分子稳定性低于H2O分子,因为O—H键键能高
难度: 中等查看答案及解析
-
以下是四种不同分子,中心原子上存在2对孤电子对的是( )

难度: 中等查看答案及解析
-
下列有关物质的性质或应用的说法不正确的是( )
A.石油裂解可获得乙烯、丙烯和丁二烯
B.煤干馏可以得到甲烷、
苯和氨等重要化工原料
C.天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点
D.酚醛树脂、聚酯纤维(涤纶)都是由缩聚反应制得的高分子化合物
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.按系统命名法,化合物
的名称为2,4﹣二乙基﹣6﹣丙基辛烷
B. 月桂烯(
)所有碳原子一定在同一平面上
C. 甲苯能使溴水和KMnO4溶液褪色
D. HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要
反应,常用浓硫酸作催化剂
难度: 简单查看答案及解析
-
将有机物的混合物在一定条件下反应:①甲醇与乙醇的混合物与浓硫
酸加热得醚;②乙二醇与乙酸酯化得酯;③氨基乙酸和丙氨酸生成二肽;④苯酚和浓溴水反应。所生成的有机物的种类由多到少的顺序是( )
A.①②③④ B.④③②① C.③②④① D.③①②④
难度: 简单查看答案及解析
-
下列实验
能达到预期目的的是( )
A.验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液
B.检验溴乙烷中溴元素时,将溴乙烷和NaOH溶液混合,充分振荡静置后加AgNO3溶液
C.向淀粉溶液中加稀硫酸加热后,加NaOH中和并做银镜反应,检验淀粉是否水解
D.除去苯中混有的少量苯酚,加入浓溴水后过滤
难度: 中等查看答案及解析
-
有机物克伦特罗(Clenbuterol)结构如下图所示。下列有关克伦特罗的叙述,不正确的是( )
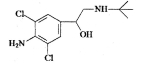
A.该物质的分子式为C12H18ON2Cl2
B.该物质易溶于盐酸
C.该物质的1H核磁共振谱图中有8个吸收峰
D.该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等
难度: 困难查看答案及解析
-
以下有关元素性质的说法不正确的是( )
A.具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④
1s22s22p63s23p4,原子半径最大的是①
B.下列原子的外围电子排布中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,对应的第一电离能最大的是④
C.①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④
D.某元素X的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X2+
难度: 简单查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子
与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子
D.最外层都只有一个电子的X、Y原子
难度: 简单查看答案及解析
-
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
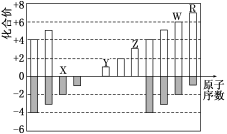
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX
3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物的碱性:Y<Z
难度: 中等查看答案及解析
-
在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”。凡具有一个手性碳原子的化合物一定具有光学活性。例如,有机物
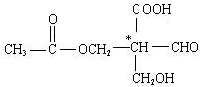 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )A、与NaOH溶液共热 B、与银氨溶液共热
C、与金属钠反应 D、与氢气发生加成反应
难度: 简单查看答案及解析
-
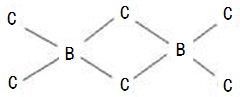
以下微粒含配位键的是( )
①N2H ②CH4 ③OH- ④NH ⑤Fe(CO)5
⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH ⑨[B(OH)4]-
A.①②④⑦⑧ B.③④⑤⑥⑦⑨ C.①④⑤⑥⑦⑧⑨ D.全部
难度: 中等查看答案及解析
-
糖类、脂肪和蛋白质是人体生命活动所必需的三大营养物质,下列说法正确的是( )
①棉花、羊毛、蚕丝和麻都属于天然纤维, 主要成分都是纤维素 ②麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原性
二糖 ③蔗糖、淀粉、油脂及其水解产物均为非电解质④变质的油脂有难闻的特殊气味,是因为油脂发生了加成反应 ⑤酒精能使蛋白质变性,可用于杀菌消毒
A. ①②③ B.⑤ C.③⑤ D. ④⑤
难度: 中等查看答案及解析
-
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得
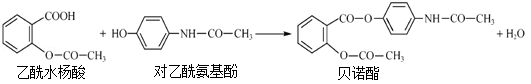
下列有关叙述正确的是(
)
A.1mol贝诺酯分子可与7molH2完全反应
B.可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
C.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
D.乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应
难度: 中等查看答案及解析
-
某高分子化合物R的结构简式为:
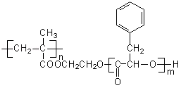 ,下列有关R的说法正确的是( )
,下列有关R的说法正确的是( )A. R的单体之一的分子式为C9H10O2
B. R完全水解后生成物均为小分子有机物
C. 通过加聚反应和缩聚反应可以生成R
D. 碱性条件下,1 mol R完全水解消耗NaOH的物质的量为2 mol
难度: 困难查看答案及解析
-
聚碳酸酯
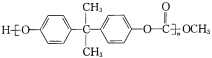 透光率好,可制作车、船、飞机的挡风玻璃。它是由碳酸二甲酯 CH3O-CO-OCH3 与下列哪种物质缩聚而成的( )
透光率好,可制作车、船、飞机的挡风玻璃。它是由碳酸二甲酯 CH3O-CO-OCH3 与下列哪种物质缩聚而成的( )A.二酚类 B.二卤化物 C.二醛类 D.二烯类
难度: 简单查看答案及解析