-
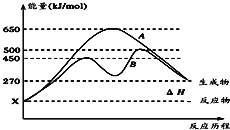
NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,如表所示是几种化学键的键能:
化学键
N≡N
F—F
N—F
键能(kJ/mol)
946
154.8
283.0
下列说法中正确的是( )
A. 过程N2(g) →2N(g)放出能量
B. 过程N(g)+3F(g)→NF3(g)放出能量
C. 反应N2(g)+3F2(g)===2NF3(g)为吸热反应
D. NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
难度: 简单查看答案及解析
-
在 298 K、1.01×105 Pa 下,将 22 g CO2通入 750 mL 1 mol·L-1 NaOH 溶液中充分反应,测得反应放出a kJ 的热量。已知在该条件下,1 mol CO2通入 1 L 2 mol·L-1 NaOH 溶液中充分反应放出b kJ 的热量。则 CO2与 NaOH 溶液反应生成 NaHCO3的热化学方程式为
A. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2b-a)kJ·mol-1
B. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2a-b)kJ·mol-1
C. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4a-b)kJ·mol-1
D. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8a-2b)kJ·mol-1
难度: 困难查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A. 氯碱工业中电解饱和食盐水时,阳极的电极反应为:2Cl--2e-=Cl2↑
B. 氢氧燃料电池的负极反应:O2+2H2O+4e-=4OH-
C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e-=Cu2+
D. 钢铁发生电化学腐蚀的正极反应:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
下列物质中,既含离子键又含极性共价键的是( )
A. Na2O2 B. KOH C. CaCl2 D. Al2O3
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3—、dD—都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>C>D B. 原子序数:d>c>b>a
C. 离子半径:C>D>B>A D. 单质的还原性:A>B>D>C
难度: 中等查看答案及解析
-
将一小段镁带投入到盛有稀盐酸的试管中,发生剧烈反应。一段时间后,用手触摸试管外壁感觉烫手。这个实验事实说明该反应
A. 为放热反应 B. 为吸热反应
C. 过程中热能转化为化学能 D. 反应物的总能量低于生成物的总能量
难度: 简单查看答案及解析
-
0.096kg碳完全燃烧可放出3147.9kJ的热量,则下列热化学方程式正确的是
A. C+O2=CO2 △H=-393.49kJ/mol
B. C(s)+O2(g)=CO2(g) △H=+393.43kJ/mo1
C. C(s)+O2(g)=CO2(g) △H=-393.49kJ/mol
D. C(s)+1/2O2(g)=CO(g) △H=-393.49kJ/mol
难度: 简单查看答案及解析
-
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后温度变化 ⑦操作所需的时间
A. ①②③⑥ B. ①③④⑤ C. ③④⑤⑥ D. 全部
难度: 简单查看答案及解析
-
己知:2H2(g)+O2(g)=2H2O(1) △H=-571.6kJ/mol ①
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452kJ/mol ②
H+(aq)+OH-(aq)==H2O(l) △H=-57.3kJ/mol
下列说法正确的是( )
A. H2(g)的燃烧热为571.6 kJ/mol
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l) △H=-57.3kJ/mol
D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) △H=+135.9kJ/mol
难度: 简单查看答案及解析
-
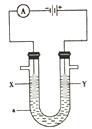
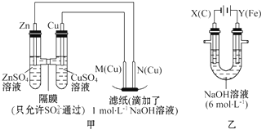
铜锌原电池(如图)工作时,下列叙述正确的是
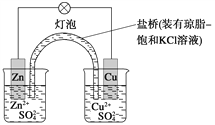
A. 正极反应为:Zn-2e-===Zn2+
B. 电池反应为:Zn+Cu2+===Zn2++Cu
C. 在外电路中,电子从正极流向负极
D. 盐桥中的K+移向ZnSO4溶液
难度: 中等查看答案及解析
-
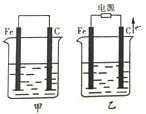
黄铜上镀金时,电镀池的阴极为( )
A.黄铜 B.金 C.石墨 D.铜
难度: 简单查看答案及解析
-
下列叙述中,正确的是
①电解池是将化学能转变成电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A. ①②③④ B. ③④
C. ③④⑤ D. ④
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
难度: 中等查看答案及解析
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A. 元素的非金属性次序为c>b>a B. a和其他3种元素均能形成共价化合物
C. d和其他3种元素均能形成离子化合物 D. 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 困难查看答案及解析
-
已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;1/2H2SO4(浓)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l) ΔH2=m,下列说法正确的是
A. 上述热化学方程式中的计量数表示分子数
B. ΔH1>ΔH2
C. ΔH2=-57.3 kJ·mol-1
D. |ΔH1|>|ΔH2|
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 中等查看答案及解析
-
研究人员研有出一种可在一分钟内完成充放电的超常性能铝离子电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其他不参与电极反应,其放电工作原理如图所示。下列说法正确的是
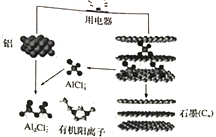
A. 放电时,有机阳离子向铝电极方向移动
B. 充电时,铝电极连接外加电源的正极,石墨电极连接外加电源的负极
C. 放电时负极的电极反应:A1-3e-+7AlCl4-=4Al2Cl7-
D. 该电池的工作原理:3Cn+4Al2Cl7-
3CnAlCl4+Al+AlCl4-
难度: 中等查看答案及解析
-
液体感科电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH为电解质。下列关于该燃料电池的叙述不正确的是
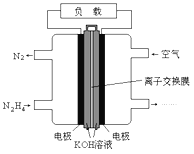
A. 电流从右侧电极经过负载流向左侧电极
B. 负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该燃料电池持续放电时,正极发生氧化反应,碱性减弱
难度: 中等查看答案及解析