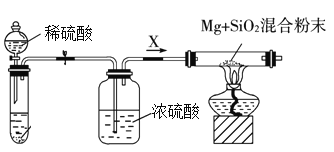
-
在当下热播的电视剧《人民的名义》中,达康书记正在参加省委召开的“开展垃圾分类,建设美丽厦门”扩大会议。达康书记问环保局长: 下列哪一组垃圾都是可回收垃圾
A. 果皮、旧报纸、废电池 B. 剩饭、鱼骨头、玻璃瓶
C. 饮料瓶、玻璃酒瓶、废作业本 D. 易拉罐、旧衣物、手机电池
难度: 简单查看答案及解析
-
达康书记接着问环保局长: 如果玻璃酒瓶属于可回收垃圾,你知道酒瓶玻璃的主要成份
A. 2CaO·SiO2 B. 3CaO·Al2O3 C. CaO·PbO·6SiO2 D. Na2O·CaO·6SiO2
难度: 简单查看答案及解析
-
达康书记又问沙瑞金书记: 在可回收垃圾中制作易拉罐的主要材质有几种? 其中有一种在元素周期表中的位置是
A. 一种,二周期IIA族 B. 两种,三周期IIA族
C. 两种,三周期IIIA族 D. 三种,四周期IA 族
难度: 简单查看答案及解析
-
达康书记又追问环保局长: 那么垃圾处理中,能随便焚烧吗? 焚烧垃圾会降低GDP 的。请问,在焚烧垃极过程中发生了
A. 不能,吸热非氧化还原反应 B. 能,吸热的氧化还原反应
C. 能,放热的非氧化还原反应 D. 不能,放热的氧化还原反应
难度: 简单查看答案及解析
-
达康书记指出垃圾就是放错地方的财富。干电池中有氯化铵,手机电池中有钴酸锂(LiCoO2),铅蓄电池中有硫酸。那么请问局长: 废旧电池属于那一类垃级? 上面所说的三种物质中有几种是离子化合物?
A. 可回收垃圾,三种 B. 有害垃圾,两种。
C. 有害垃圾,三种 D. 其它垃圾,两种。
难度: 简单查看答案及解析
-
我国清代《本草纲目拾遗》中记叙无机药物335 种,其中“强水”条目下写道,“性最烈。能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( )
A. 氨水 B. 醋 C. 硝酸 D. 卤水
难度: 简单查看答案及解析
-
著名化学家徐光宪(画面正中),因为在稀土萃取领域取得的卓越成就被誉为“稀土界的袁隆平”。稀土元素是指镧系元案,加上钪和钇两种元素。下列说法正确的是

A. 稀士元素一共有16种元素
B. 要萃取出碘酒中的碘可以使用氢氧化钠溶液作萃取剂
C. 稀土元素全部是金属元素
D. 某些稀土元素在地壳中的含量可能高于铝
难度: 简单查看答案及解析
-
化学科学需要借助化学专用术语来描述,下列有关化学用语的使用正确的是( )
A. NH4Cl的电子式:
 B. S2-的结构示意图:
B. S2-的结构示意图: C. 用电子式表示HCl形成过程:
 D. 中子数为20的氯原子:
D. 中子数为20的氯原子: 难度: 简单查看答案及解析
-
下列反应过程中,同时有离子键、共价健的断裂和形成的是
A. 3NO2+H2O==2HNO3+NO B. NH4Cl
NH3↑+HC1↑
C. 2Na+O2
Na2O2 D. 2Na2O2+2H2O==4NaOH+O2↑
难度: 中等查看答案及解析
-
某微粒的结构示意图为
,当x-y=10时,该微粒为
A. 原子 B. 阳离子 C. 阴离子 D. 无法判断
难度: 中等查看答案及解析
-
化学反应中必然伴随着物质变化和能量变化,下列说法正确的是( )
A. 浓硫酸溶于水共价健断裂并放出大量的热,所以该过程是放热反应
B. 吸热反应一定要在加热或高温条件下才能进行
C. 右图可表示放热反应中的能量变化
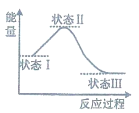
D. 焰色反应有能量变化,所以焰色反应是化学反应
难度: 简单查看答案及解析
-
下列有关科学家及其创建理论的描述中,错误的是( )
A. 汤姆生提出葡萄干面包式模型 B. 道尔顿创立分子学说
C. 门捷列夫发现了元素周期律 D. 卢瑟福提出了核式原子模型
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,22gCO2中含有NA个碳氧键
B. 1mol/LNaCl溶液含有NA个Na+
C. 1molNa2O2和CO2充分反应转移2NA个电子
D. 标准状况下,22.4L水中含有NA个H2O分子
难度: 简单查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是
①a-c=m+n ②元素的原子序数a>b>c > d
③元素非金属性Z>R ④最高价氧化物对应水化物的碱性X>Y
⑤HnZ 的还原性强于HmR ⑥原子半径大小Y>X>R>Z
A. ①②③⑥ B. ③④ C. ①②③④ D. ②③⑥
难度: 中等查看答案及解析
-
某溶波中加入铝粉能产生氢气,则该溶液中不可能大量共存的一组离子是
A. K+、Cl-、H+ B. NH4+、NO3-、SO42- C. K+、A13+、Br- D. Na+、K+、SiO32-
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 硫酸铝溶液中加入过量氨水: A13+ +3OH-=Al(OH)3↓
B. 冷的氢氧化钠溶液中通入氯气: Cl2+2OH-=ClO-+Cl-+H2O
C. NaHSO4溶液与Ba(OH)2溶液混合:SO42-+Ba2+=BaSO4↓
D. Fe(OH)3溶解于氢碘酸中: Fe(OH)3 + 3H+= Fe3++3H2O
难度: 简单查看答案及解析
-
某同学设计如下元素同期表,以下说法正确的是

A. 白格中都是主族元素,灰格中都是副族元素
B. X、Y、Z元素分别为N、P、O
C. 原子半径:Z>X>Y
D. X、Y、Z的气态氢化物中稳定性最高的是X的氢化物
难度: 中等查看答案及解析
-
若N60与C60结构相似的另一种“足球分子”,则下列说法正确的是
A. N60分子中只含有共价键 B. N60和14N都是氮的同位素
C. N60是一种新型化合物 D. N60与C60互为同素异形体
难度: 简单查看答案及解析
-
利用右图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
装置
A
浓硝酸
Na2CO3
Na2SiO3溶液
非金属性: N>C>Si
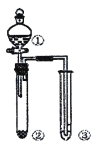
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡益均可以生成白色沉淀
D
浓硝酸
铝片
氢氧化钠溶液
浓硝酸具有强氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如表所示的五种元素中,W、X、Y、Z 为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
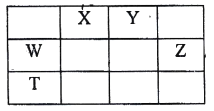
A. X、Y、Z 三种元素最低价氢化物的沸点依次升高
B. 由X、Y 和氢三种元素形成的化合物中只能有共价键
C. 由X、Y 两种元素形成的化合物都是酸性氧化物
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
难度: 中等查看答案及解析
-
己知X、Y为短周期元素,两元素形成化合物XY2,已知其原子序数分别为a和b,则a不可能为( )
A. b+4 B. b-5 C. b+6 D. b+8
难度: 中等查看答案及解析
-
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反成的是
选项
甲
乙
丙
A
FeCl2
Cl2
NaOH
B
AlCl3
NaOH
H2SO4
C
SiO2
KOH
HF
D
SO2
NaOH
NaHCO3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于指定粒子构成的几种描述中不正确的是( )
A. H3O+与 OH-具有相同的质子数和电子数
B. 第114 号元素的一种核素114X与82Pb 具有相同的最外层电子数
C. 37Cl与39K具有相同的中子数
D. O22-和S2-具有相同的质子数和电子数
难度: 简单查看答案及解析
-
FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示,下列说法错误的是
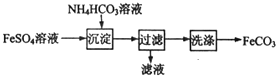
A. 可利用KSCN溶液检验FeSO4溶液是否变质
B. 沉淀过程中有CO2气体放出
C. 过滤搡作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D. 产品FeCO3在空气中高温分解可得到纯净的FeO
难度: 中等查看答案及解析
-
根据元素周期律和元素周期表的知识分析下面的推断,其中错误的是
A. 铍(Be)的氧化物及氢氧化物可能具有两性 B. Sr(OH)2 的碱性强于Ba(OH)2
C. 砹(At)的单质是有色固体,HAt 很不稳定 D. AsH3是无色、有毒的气体
难度: 简单查看答案及解析
-
已知A、B、X、Y之间存在如下转化关系: A+B→X+Y,下列说法正确的是( )
A. 若A为铁,X为氢气,则B一定是酸
B. 若B为H2O2,则X或Y中不可能有O2
C. 若A、B、X、Y均为化合物,该反应一定属于复分解反应
D. 若A和X为单质,则A与X对应元素可能在同一周期,也可能在同一主族
难度: 中等查看答案及解析
-
已知断开1molH-H键吸收的能量为436kJ,形成lmolN-H键放出的能量为391kJ,根据化学方程式N2+3H2
 2NH3,反应完1molN2放出的能量为92.4kJ,则断开1molN≡N键吸收的能量是
2NH3,反应完1molN2放出的能量为92.4kJ,则断开1molN≡N键吸收的能量是A. 945.6 kJ B. 869kJ C. 649.6kJ D. 431kJ
难度: 简单查看答案及解析
-
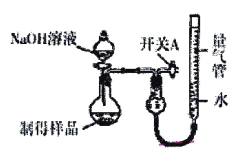
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
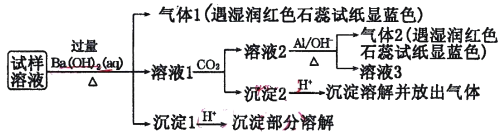
己知: 3NO3-+8A1+5OH-+18H2O====3NH3↑+8[Al(OH)4]-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A. 试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B. 试样中一定含Al3+
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
难度: 困难查看答案及解析
-
ClO2是一种杀菌消毒效率高二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3 +H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是
A. 该反应中断裂和形成的只有离子键 B. 氧化剂与还原剂的物质的量之比为2:1
C. 每生成1molClO2转移电子数目为2NA D. H2C2O4的氧化性强于ClO2的氧化性
难度: 中等查看答案及解析
-
一块11.0 g的铁铝合金,加入一定量的稀硫酸后完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 mol ·L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法不正确的是( )
A. 该合金中铁的质量为5.6 g
B. 该合金与足量氢氧化钠溶液反应,转移的电子数为0.6NA
C. 合金与稀硫酸反应共生成0.45 mol H2
D. 所加的稀硫酸中含0.6 mol H2SO4
难度: 中等查看答案及解析