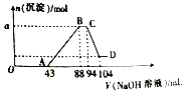-
硅及其化合物在生产生活中应用广泛,下列说法不正确的是
A.水泥是建筑工业的基础材料,可用黏土、石灰石等原料来制得
B.常温下,二氧化硅可与NaOH溶液反应
C.向硅酸钠溶液中滴加稀盐酸,溶液中不会出现沉淀
D.晶体硅是良好的半导体材料
难度: 简单查看答案及解析
-
下列物质的使用不涉及化学变化的是
A.醋酸除水垢 B.活性炭除冰箱异味
C.氢氟酸蚀刻玻璃 D.生石灰作干燥剂
难度: 简单查看答案及解析
-
在某无色碱性溶液中能大量共存的离子组是
A.Na+、K+、HCO3- B.NH4+、Al3+、SO42-
C.Na+、AlO2-、NO3- D.Cu2+、SO42-、Cl-
难度: 中等查看答案及解析
-
下列试剂不能用于区分SO2和CO2的是
A.澄清石灰水 B.酸性高锰酸钾溶液-
C.溴水 D.硝酸钡溶液
难度: 简单查看答案及解析
-
下列氯化物中,既能由金属与氯气直接制得,又能由金属与盐酸反应制得的是
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
难度: 简单查看答案及解析
-
下列化合物中依次属于氧化物、碱、盐的一组是
A.Na2O2、KOH、CaO B.CO、NaOH、KCl
C.H2O、H2SO4、NaCl D.CuO、Na2O2、CaCO3
难度: 简单查看答案及解析
-
下列关于浓硝酸和浓硫酸的叙述中正确的是
A.常温下均可用铝制容器运输
B.常温下均能与铜较快反应
C.露置在空气中,容器内酸液质量都减少
D.露置在空气中,容器内酸液质量都增大
难度: 简单查看答案及解析
-
使用容器瓶配制溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏高的是
A.溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
B.转移溶液前容量瓶内有少量蒸馏水
C.定容时,俯视容量瓶的刻度线
D.定容摇匀时,发现液面降低,又补加少量水,重新达到刻度线
难度: 中等查看答案及解析
-
下列对物质的用途及解释都正确的是
选项
物质
用途
解释
A
SO2
食品漂白剂
SO2具有还原性
B
NaClO
消毒剂
NaClO具有强氧化性,能杀灭细菌
C
Na2CO3
中和过多胃酸
Na2CO3属于碱
D
浓硫酸
干燥剂
浓硫酸具有脱水性
难度: 简单查看答案及解析
-
2015年10月,屠呦呦因发现青蒿素和双氢青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。双氢青蒿素的化学式为C15H24O5,相对分子质量为284。下面关于双氢青蒿素的说法正确的是
A.1mol双氢青蒿素的质量为284g∙mol-1
B.双氢青蒿素的摩尔质量等于它的相对分子质量
C.14.2g双氢青蒿素中含有的原子总数为2.2NA
D.含有6.02×1023个碳原子的双氢青蒿素的物质的量为1mol
难度: 中等查看答案及解析
-
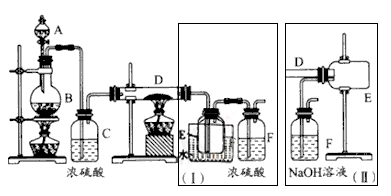
下列装置或操作不能达到实验目的的是
目的
A.实验室制取并收集O2
B.检查装置气密性
C.制取蒸馏水
D.分离水和四氯化碳
装
置
或
操
作


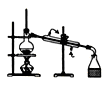
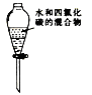
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.向CuSO4溶液中加入NaOH:Cu2++2OH-=Cu(OH)2↓
C.在酸性溶液中,KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.向Al2(SO4)3溶液中加入过量的NH3∙H2O:Al3++4NH3∙H2O=AlO2-+4NH4++2H2O
难度: 困难查看答案及解析
-
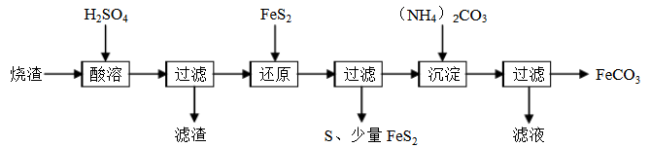
下列除杂方案正确的是
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
CO(g)
CO2(g)
饱和NaHCO3溶液、浓硫酸
洗气
B
FeCl2(aq)
CuCl2
铁粉
过滤
C
Cl2(g)
HCl(g)
NaOH溶液、浓硫酸
洗气
D
NaHCO3(aq)
Na2CO3(aq)
盐酸
—
难度: 中等查看答案及解析
-
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应,二者比较,相等的是( )
A.铜片消耗完所需时间 B.反应生成的气体体积(标准状况下)
C.反应中氧化剂得到的电子总数 D.反应后溶液中硝酸根离子的浓度
难度: 中等查看答案及解析
-
如图是一种试验某气体化学性质的实验装置,图中B为弹簧夹。在A处通入未经干燥的氯气,当打开弹簧夹B时,C中红色布条颜色褪去;当关闭弹簧夹B时,C中红色布条颜色无变化。则D瓶所盛的溶液是
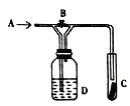
A.饱和NaCl溶液 B.浓硫酸 C.水 D.稀盐酸
难度: 困难查看答案及解析
-
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M,关于该反应的说法中不正确的是
A.M为H2O
B.SnCl62-是氧化产物
C.还原性:As>SnCl2
D.每生成1molAs,反应中转移电子的物质的量为3mol
难度: 困难查看答案及解析