-
某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:“还原”时,FeS2与H2SO4不反应。
(l)“酸溶”时Fe2O3发生的化学反应方程式为________
(2)实验室“过滤”时所用的玻璃仪器有烧杯、________
(3)“还原”时生成S的离子方程式为________
(4)检验FeCO3是否洗净的方法是________
(5)“滤液”中的溶质可能有____(填化学式)。
-
某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
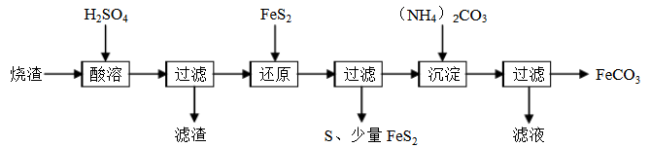
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、II被还原,其中反应Ⅰ为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是___________________。
(2)滤渣的成分是___________(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是__________________。
(4)①配平反应II的离子方程式:_______Fe3++_______FeS2=_______S↓+_______Fe2+。
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
| 离子 | 离子浓度(mol∙L-1) |
| 还原前 | 还原后 |
| Fe2+ | 0.10 | 2.50 |
| SO42- | 3.50 | 3.70 |
| | |
则反应Ⅰ、II中生成Fe2+的物质的量之比为_________。
-
某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式:  ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
| 离子 | 离子浓度(mol/L) |
| 还原前 | 还原后 |
| Fe2+ | 0.10 | 2.50 |
| SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________
-
某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为 .
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是 .“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 .
(3)①写出“还原”时反应Ⅱ的离子方程式: .
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
| 离子 | 离子浓度(mol•L﹣1) | |
| 还原前 | 还原后 |
| Fe2+ | 0.10 | 2.5 |
| SO42﹣ | 3.5 | 3.7 |
请计算反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比(写出计算过程).
-
硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
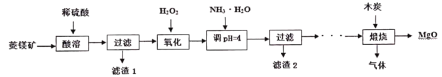
(1)MgCO3与稀硫酸反应的离子方程式是____________。
(2)加入H2O2氧化时,发生反应的离子方程式为____________________。
(3)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
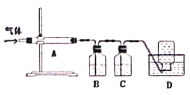
①A中现象是________,A中收集的物质可用热的NaOH溶液去除,写出该反应的化学反应方程式:__________________。
②B中盛放的溶液可以是_________(填字母)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.品红溶液 e.酸性KMnO4溶液
③D中收集的气体可以是________(填化学式)。
-
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
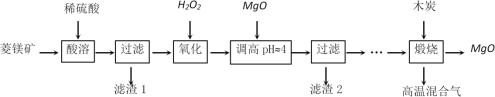
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为_____________________________。
(2)滤渣1的化学式为__________________。
(3)写出流程中“氧化”的离子方程式为______________________________________。
(4)调节pH时,使用pH试纸的具体操作是取一小块pH试纸放在洁净的玻璃片上,_______________________________________________________;滤渣2中除了过量的MgO外,还含有的物质是____________。
(5)高温煅烧过程中,同时存在以下反应:2MgSO4+C 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
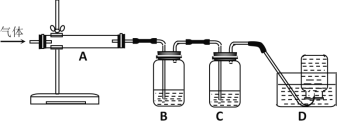
①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
-
黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
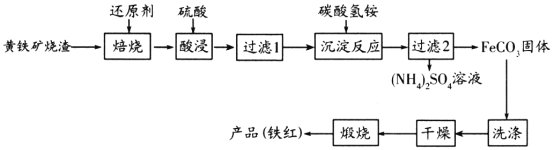
回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时反应温度不宜过高,其原因为________(用化学方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示: )
)
-
黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
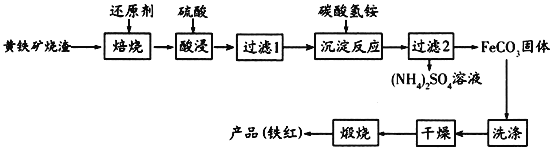
回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时不宜混入过多空气,其原因为______________________(用离子方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示: )
)
-
由硫铁矿烧渣(主要含Fe2O3和SiO2)制备绿矾(FeSO4·7H2O),再通过绿矾制备铁矾[FeO(OH)]的流程如下:(已知FeS2和铁矾均难溶于水)
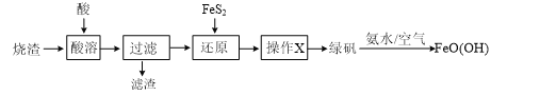
(1)“酸溶”步骤中,最好采用___________________(填“盐酸”、“硫酸”或“硝酸”)溶解烧渣。
(2)写出“还原”步骤发生反应的离子方程式:___________________。
(3)对“还原”后的溶液进行“操作X”,可得到绿矾。“操作X”是指___________________,过滤,洗涤,干燥。
(4)请补充完整检验“还原”后所得溶液中是否含有Fe3+的实验方案:取“还原”后溶液于试管内,___________________。
(5)最后一步制备铁矾的反应中,还生成一种可作化肥的物质,它的化学式为___________________。
-
利用硫酸渣(主要成分为Fe2O3和少量的SiO2、FeO)可以制备高纯度的氧化铁,制备流程如图:
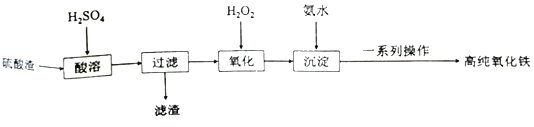
(1)滤渣的主要成分是___。
(2)“氧化”时发生反应的离子方程式为___。
(3)检验沉淀是否完全的方法为___。
(4)一系列操作包括:过滤、沉涤、干燥、___。
(5)用高温分解FeSO4也可以制备较纯的Fe2O3,写出反应的化学方程式___。
(6)上述硫酸渣含铁28%,现需高纯氧化铁64吨,理论上需用硫酸渣多少吨?___(写出计算过程)



 ____________
____________







