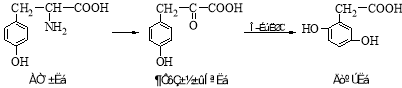
-
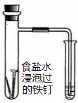
(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子。请回答下列问题:
(1)C的单质分子的结构式为 ;ED的电子式为 。
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为 。
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为 ,由此可知CD和FD2中还原性较强的是 (填化学式)。
(4)A、C、D、F四种元素按原子个数比为5 :1 :4 :1形成化合物甲,则甲的化学式为 。将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp=x ,则混合溶液中酸根离子的浓度为 mol / L(用含x的代数式表示,混合后溶液体积变化忽略不计)。
-
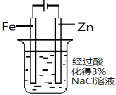
(14分)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
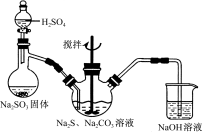
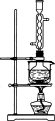
图1 图2
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是_____________________。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有
(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,
该反应的化学方程式为:2Na2S2O3+I2 = 2NaI+Na2S4O6
①利用KIO3、KI和HCl作原料可配制标准碘溶液。写出配制时所发生反应的离子方程式 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果___________(填“偏高”“偏低”或“不变”)。
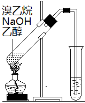
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
①将已称量好的工业级Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待 时,停止加热,将烧瓶取下;
④ __________________________;
⑤ __________________________;
⑥将所得固体洗涤、干燥,即可得到Na2S·9H2O晶体。
-
(16分)某药学杂志报道了一种具有明显抗癌活性的药物,其结构如图所示。J是其同分异构体,J的合成路线如下(部分产物已略去):
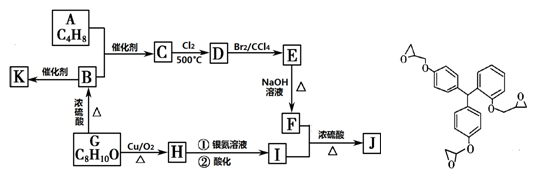
已知:① CH2=CHR1 + CH2=CHR2  CH2=CH2 + R1CH=CHR2
CH2=CH2 + R1CH=CHR2
② R—CH2—CH=CH2 + Cl2  R—CHCl—CH=CH2 + HCl
R—CHCl—CH=CH2 + HCl
③ 核磁共振氢谱图显示A分子中不同环境氢原子个数比为3 :1;F是油脂水解的产物之一,能与水以任意比例混溶;K是一种高分子化合物。
请回答下列问题:
(1)该药物可能具有的性质是 (填字母编号)。
a.易溶于水 b.能发生加成反应 c.能发生水解反应 d.能发生取代反应
(2)H分子中含有官能团的名称是 ;G的结构简式为 。
(3)按照系统命名法,A的名称是 。
(4)C→D的反应类型为 。
(5)写出下列反应的化学方程式:
B→K ;F+I→J 。
(6)写出同时满足下列条件的I的所有同分异构体的结构简式 。
①分子中含有苯环结构;②能发生银镜反应;③苯环上的一氯代物有两种。
-
(14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 。在密闭容器
2CO2(g)+ N2(g) 。在密闭容器
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。
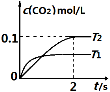
图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
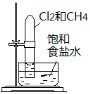
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
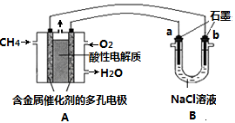
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。