-
下列说法中正确的是
A.胶体中分散质粒子直径小于1×10-9m
B.区别胶体与溶液的最简单的方法是丁达尔效应
C.往NaOH溶液中滴入FeCl3溶液立即可制得胶体
D.用半透膜分离胶体和悬浊液
难度: 简单查看答案及解析
-
下列物质的电离方程式不正确的是
A.NaHCO3===Na++H++
B.
C.AlCl3===Al3++3Cl-
D.NaHSO4===Na++H++
难度: 简单查看答案及解析
-
医学界通过用14C标记的C60发现一种羧酸衍生物,在特定条件下,它可以通过断裂DNA抑制艾滋病病毒的繁殖。下列有关叙述中,正确的是
A.14C与12C的化学性质完全不同
B.14C与14N含有的中子数相同
C.14C60和12C60是碳元素的同素异形体
D.14C与12C、13C互为同位素
难度: 简单查看答案及解析
-
向某晶体的溶液中加入含Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,下列结论中错误的是
A.Fe3+的氧化性比溴的氧化性强
B.该晶体中一定含有SCN-
C.Fe2+与SCN-不能形成红色化合物
D.Fe2+被溴氧化成Fe3+
难度: 简单查看答案及解析
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.只有非金属能形成含氧酸或含氧酸盐
B.H3O+与OH-具有相同的质子数和电子数
C.第三周期元素的最高正化合价等于它所处的主族序数
D.五种粒子
,所属元素的种类是5种
难度: 简单查看答案及解析
-
检验某未知溶液中是否含有SO42-的下列操作中最合理的是
A.加入硝酸酸化的Ba(NO3)2溶液
B.先加HNO3酸化,再加Ba(NO3)2溶液
C.先加盐酸酸化,再加BaCl2溶液
D.加入盐酸酸化了的BaCl2溶液
难度: 简单查看答案及解析
-
下列说法正确的是
A.云、雾、烟都属于胶体,其分散剂都是空气
B.新制氯水中的所有物质都是电解质
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.制造光导纤维的原料是晶体硅
难度: 简单查看答案及解析
-
《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.易溶解于强酸和强碱
D.x等于6
难度: 简单查看答案及解析
-
下列关于物质结构和化学用语的说法正确的是
A.NH3的空间构型为三角锥形
B.1个二氧化碳分子中存在2个共用电子对
C.NaOH和Na2O中所含的化学键类型完全相同
D. PCl5和BF3分子中所有原子的最外层都达到8电子稳定结构
难度: 简单查看答案及解析
-
世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成石灰乳
②在海水中加入石灰乳,过滤,洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤
④在氯化氢热气流中干燥晶体
⑤电解上述晶体的熔融物。
下列说法正确的是
A.镁元素在元素周期表中位于第4周期、第ⅡA族
B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C.在氯化氢热气流中干燥晶体的目的是加快干燥速度
D.步骤⑤也可以采用电解该晶体水溶液的方法
难度: 中等查看答案及解析
-
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是
A.该物质属于两性氢氧化物
B.该物质是Al(OH)3和Na2CO3的混合物
C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+
D.该药剂不适合于胃溃疡患者服用
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.滴入KSCN显红色的溶液:Na+、Cu2+、Br-、
B.滴入酚酞显红色的溶液:Na+、Al3+、
、Cl-
C.c(Fe2+)=1 mol·L-1的溶液:H+、Na+、Cl-、
D.加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、
难度: 中等查看答案及解析
-
下列各微粒:
具有相同质子数和电子数的一组是
A.①②③ B.①②④ C.②③④ D.①③④
难度: 简单查看答案及解析
-
关于pH相同的醋酸和盐酸,下列叙述不正确的是
A.取等体积的两种酸分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n
B.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸
C.取等体积的两种酸分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸消耗的多
D.两种酸中c(CH3COO-)=c(Cl-)
难度: 中等查看答案及解析
-
某同学用下列装置制备并检验Cl2的性质。
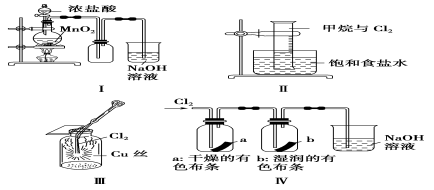
下列说法正确的是
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同的电子层结构,下列关系正确的是
A.质子数:c>d
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
难度: 简单查看答案及解析
-
下列关于Na2O2的叙述正确的是
A.Na2O2晶体中的阴离子与阳离子的物质的量之比为1∶1
B.Na2O2晶体为离子晶体,且含极性共价键
C.Na2O2应保存于带玻璃塞的广口瓶中
D.Na2O2与盐酸反应,不仅有盐和水生成,同时会放出无色气体
难度: 简单查看答案及解析
-
下列有关说法中不正确的是
A.铁与Cl2、盐酸均能发生反应,但生成的含铁物质组成不同
B.分别加热蒸干并灼烧铁、铝的氯化物溶液,最后得到的物质均为金属氧化物
C.等物质的量的Na、Cu、Al与足量氯气反应时,消耗的氯气一样多
D.常温下,铁片、铝片与浓硫酸的反应均只能停留在金属的表面上
难度: 简单查看答案及解析
-
短周期主族元素A,B,C,D,E的原子序数依次增大,其中只有C为金属元素,B是地壳中含量最多的元素,C原子的最外层电子数和A相等;C,D两元素原子的质子数之和是A,B两元素质子数之和的3倍,下列叙述正确的是
A.元素的原子半径:A<B<C<D<E
B.对应氢化物的热稳定性:D>E
C.B与C、B与D形成的化合物中化学键类型相同
D.5种元素中最高价氧化物对应的水化物酸性最强的是E
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.c(H+)=c(OH-)=10-6 mol·L-1的溶液
B.pH=7的溶液
C.滴入酚酞显无色的溶液
D.酸与碱恰好完全反应生成正盐的溶液
难度: 简单查看答案及解析
-
现有如下几个离子方程式①CaCO3+2H+===Ca2++H2O+CO2↑
②
③
④
,
由此得出的如下结论中不正确的是
A.
与H+、Ca2+不能大量共存
B.H2CO3的酸性比HClO强,比H2SO3弱
C.H2SO3是一种强酸
D.H2CO3、HClO都属于弱酸
难度: 中等查看答案及解析
-
下列说法正确的是
A.SO2溶于水,其水溶液能导电,说明SO2是电解质
B.向纯水中加入盐酸或金属钠都能使水的电离平衡逆向移动,水的离子积不变
C.向氯水中加入Na2CO3可使溶液中c(HClO)增大
D.室温下,将浓度为0.1 mol·L-1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变
难度: 中等查看答案及解析
-
将3.2 g Cu跟30.0 mL 10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3-的物质的量为
A.0.5a mol B.(0.1+a)mol
C.0.1a mol D.2a mol
难度: 中等查看答案及解析
-
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图。根据图示判断,下列结论中不正确的是( )。

A.N点时溶液中的溶质只有NaCl
B.M点之前加入的是NaOH溶液,M点之后加入的是盐酸
C.c(NaOH)=c(HCl)
D.原混合溶液中c(MgCl2)∶c(AlCl3)=1∶1
难度: 困难查看答案及解析