-
(12分)Ⅰ、现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在电离平衡为______________________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为_________;
Ⅱ、某一元弱酸(用HA表示)在水中的电离方程式是HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向________(填“正”、“逆”)反应方向移动,理由是_______________________________________。
(2)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”)。
-
(14分)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在电离平衡为________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
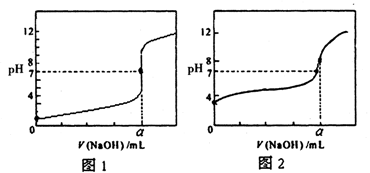
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=________mL。
-
现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,回答下列问题:
(1)甲溶液的pH=________ ________;
(2)丙溶液中存在的电离平衡为(用电离平衡方程式表示)________;
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
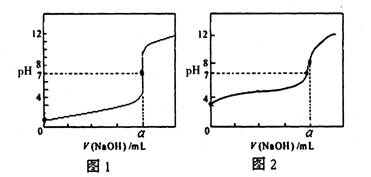
①甲溶液滴定丙溶液的曲线是________ ________(填“图1”或“图2”);
②a=________ ________mL。
-
现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在电离平衡为________
(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
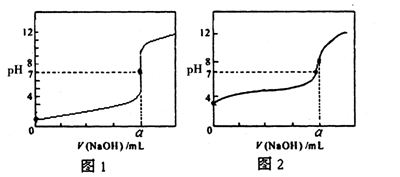
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=________mL。
-
常温下,现有浓度都为0.1mol·L-1HX、HY的溶液各20ml,分别用0.1 mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。

下列判断错误的是
A.滴定过程中,水电离的c(H+)·c(OH-)均不变
B.HX的电离程度小于HY的电离程度
C.V=10ml时,c(HX)+c(X-)=2c(Na+)
D.V=20ml时,c(Y-)>c(X-)
-
常温下,现有浓度都为0.1mol·L-1HA、HB的溶液各20mL,分别用0.1 mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。下列判断错误的是
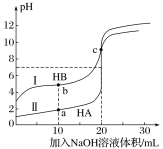
A. 滴定过程中,水电离的c(H+)·c(OH-)均不变
B. 相同条件下,HB的电离程度小于HA的电离程度
C. V=10mL时,c(HB)+c(B-)=2c(Na+)
D. V=20mL时,c(A-)>c(B-)
-
常温下,现有浓度均为0.1 mol·L—1的五种电解质溶液:
A.Na2CO3 B.HCl C. CH3COOH D. CH3COONa E.NaOH
(1)这五种溶液中水的电离程度最大的是_______。(填字母)
(2)若将C、E溶液等体积混合后所得溶液pH___________7(填“>”“<”或“=”),
(3)将C、E溶液混合,若有c(CH3COO-)=c(Na+),则混合溶液呈_____性。
-
下图所示与对应叙述相符的是( )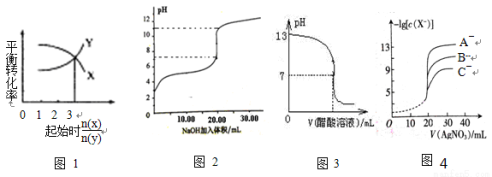
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z
Z
B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂
C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C-
-
下图所示与对应叙述相符的是
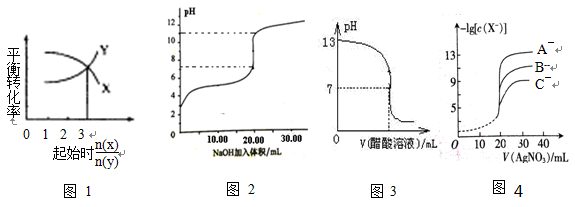
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z
Z
B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂
C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13 时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C-
-
下列说法正确的是( )
A.改变条件,反应物的转化率增大,平衡常数也一定增大
B.常温下,V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2
C.在0.1mol•L﹣1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32﹣的离子浓度均增大
D.反应2NO2(g)⇌N2O4(g)△H<O,升高温度该反应平衡常数增大
H++A-,回答下列问题:






